

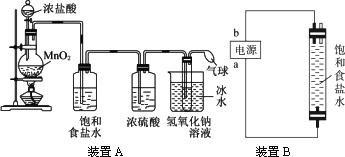
请完成下列问题:
(1)装置A的大试管内发生反应的离子方程式为:________________________。
(2)装置A中能否省去盛饱和NaCl溶液的洗气瓶?理由是:________________________。
(3)装置A中能否省去盛浓硫酸的洗气瓶?理由是:________________________。
(4)装置A中能否省去盛冰水的烧杯?理由是:________________________。
(5)装置B中制备时发生的电解反应的化学方程式为________________________。
(6)装置B中a端应接电源的极,理由是:________________________。
(1)Cl2+2OH-==Cl-+ClO-+H2O
(2)不能,氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低NaClO的产量和纯度
(3)能,少量水蒸气进入试管中不影响反应
(4)不能,氯气和水的反应是放热反应,反应温度升高时,可能引起副反应,生成NaClO3
(5)2NaCl+2H2O==H2↑+Cl2↑+2NaOH
(6)正产生的Cl2能充分和氢氧化钠溶液接触并发生反应
解析:装置A的气体发生装置是制备Cl2的,反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,气体通过饱和NaCl溶液是为了除去Cl2中的杂质气体HCl,通过浓H2SO4时是为了干燥Cl2,通入冷却的NaOH溶液则是来制备消毒液NaClO,反应为Cl2+2NaOH==NaCl+NaClO+H2O。
MnCl2+Cl2↑+2H2O,气体通过饱和NaCl溶液是为了除去Cl2中的杂质气体HCl,通过浓H2SO4时是为了干燥Cl2,通入冷却的NaOH溶液则是来制备消毒液NaClO,反应为Cl2+2NaOH==NaCl+NaClO+H2O。
装置B是利用电解饱和食盐水法来制备NaClO,反应为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,Cl2+2NaOH==NaCl+NaClO+H2O,与a相连的下端电极上产生Cl2,为阳极,则a电极必定为正极。
2NaOH+Cl2↑+H2↑,Cl2+2NaOH==NaCl+NaClO+H2O,与a相连的下端电极上产生Cl2,为阳极,则a电极必定为正极。
问题分析:
(1)离子方程式为:MnO2+4H++2Cl-==Mn2++Cl2↑+2H2O(烧瓶中)
大试管中的是:Cl2+2OH-==ClO-+Cl-+H2O
(2)若省去盛饱和NaCl溶液的洗气瓶,则会使HCl气体进入大试管中与NaOH溶液反应,从而使NaClO的产量降低,由于杂质NaCl增多,使NaClO的纯度也降低。
(3)若不干燥Cl2也可以,因为少量的H2O对Cl2跟NaCl溶液的反应不会造成太大的影响。
(4)盛冰水的烧杯不能省去,因为Cl2和H2O反应是放热反应,反应温度升高时,可能引起副反应,生成NaClO3。
(5)2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(6)a极是正极,这样下端电极是阳极,电解Cl-产生Cl2,Cl2向上逸出能与NaOH溶液接触更加充分,反应生成NaClO。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第15期 总第171期 人教课标版 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:南昌二中2008届高三第一次考试化学试卷 题型:058
近年来全世界经历了多种传染性疾病(如非典、疯牛病、高致病性禽流感等)的袭扰,因此,经常性地对环境进行消毒,是预防各种传染性疾病的有效措施.某研究小组为制备消毒液(主要成分是NaClO),设计了A、B两套装置(B装置中电极材料均为石墨).并查阅到下列资料:在加热的情况下卤素单质和碱液发生如下反应:
3X2+6OH-![]() 5X-+
5X-+![]() +3H2O
+3H2O
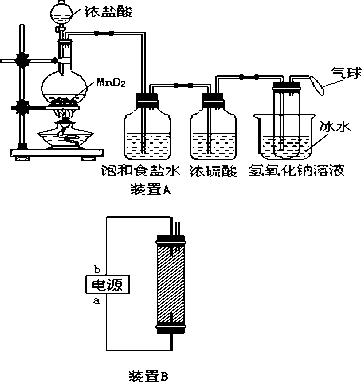
请完成下列问题:
(1)写出装置A烧瓶中发生反应的化学方程________.
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的________(填“能”或“不能”).
(3)装置A中盛冰水的烧杯的作用是________________.
(4)利用装置B制备消毒液时有关反应的化学方程式为________.
(5)装置B中a端应接电源的________极,理由是_________________________.
查看答案和解析>>
科目:高中化学 来源:贵州省白云二中2009届高考专题复习化学测试卷第四部分卤素 题型:058
近年来全世界经历了多种传染性疾病(如非典、疯牛病、高致病性禽流感等)的袭扰,因此,经常性地对环境进行消毒,是预防各种传染性疾病的有效措施.某研究小组为制备消毒液(主要成分是NaClO)设计了A、B两套装置(B装置中电极材料均为石墨).并查阅到下列资料:“在加热的情况下卤素单质和碱液发生如下反应:
3X2+6OH-![]() 5X-+XO3-+3H2O”
5X-+XO3-+3H2O”
请回答下列问题:
(1)写出装置A烧瓶中发生反应的化学方程式:
________________________________________;
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的________填“能”或“不能”)
(3)装置A中盛冰水的烧杯的作用是________;
(4)利用装置B制备消毒液时有关反应的化学方程式为:________;
(5)装置B中a端应接电源的________极,理由是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
3X2+6OH-![]() 5X-+
5X-+![]() +3H2O
+3H2O
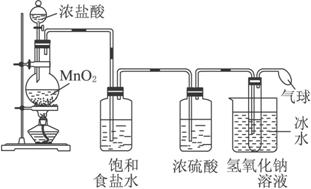
装置A
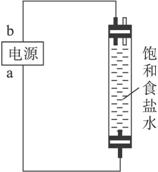
装置B
请完成下列问题:
(1)写出装置A烧瓶中发生反应的化学方程式________________________________ 。
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的_________(填“能”或“不能”)。
(3)装置A中盛冰水的烧杯的作用是_________________________________________。
(4)利用装置B制备消毒液时有关反应的化学方程式为__________________________。
(5)装置B中a端应接电源的_________极,理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
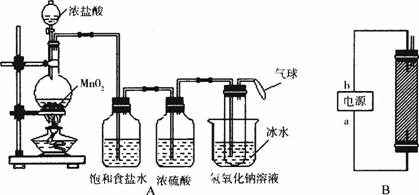
图11-7
请回答下列问题:
(1)写出装置A烧瓶中发生反应的化学方程式:_______________________________________。
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的?__________(填“能”或“不能”)。
(3)装置A中盛冰水的烧杯的作用是____________________________________________。
(4)装置B制备消毒液时有关反应的化学方程式为_________________________________。
(5)a端应接电源的__________极,理由是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com