
下列操作不能达到目的的是( )
| 选项 | 目的 | 操作 |
| A | 配制100 mL 1.0 mol·L-1 CuSO4溶液 | 将25 g CuSO4·5H2O 溶于100 mL蒸馏水中 |
| B | 除去KNO3 中少量NaCl | 将混合物制成热的饱和 溶液,冷却结晶,过滤 |
| C | 在溶液中将MnO 完全转化为Mn2+ | 向酸性KMnO4溶液 中滴加H2O2溶液至 紫色消失 |
| D | 确定NaCl溶液中是 否混有Na2CO3 | 取少量溶液滴加CaCl2 溶液,观察是否出现白 色浑浊 |
科目:高中化学 来源: 题型:
X、Y、Z代表三种元素的原子,X、Y有相同的电子层,Y、Z最外层电子数相同,已知三种元素的原子最外层电子数之和为17,三种元素的质子数之和为31。则X、Y、Z可能是
A N、O、S B Cl、N、P C Be、F、Cl D F、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好
B.取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管
C.胶头滴管取完一种试液后,可直接取另一种不与其反应的试液
D.取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.摩尔是物质的质量的单位
B.CH4的摩尔质量为16g
C.阿伏加德罗常数约为6.02×1023mol-1
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中属于加成反应的是
A.乙烯使酸性高锰酸钾溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式____________________________________________________。
(2)实验装置(如图所示)
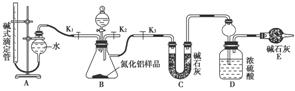
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为a mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞_____________,打开活塞______________,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞_____________,打开活塞_____________,通过分液漏斗加入过量____________(填化学式),与烧瓶内物质充分反应。
④__________________(填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g,
(4)数据分析
①AlN的质量分数为___________________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________________(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为________。(该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:
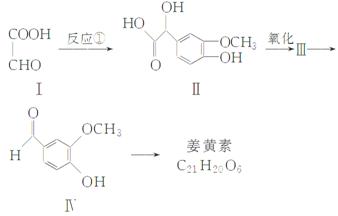
化合物Ⅰ可以由以下合成路线获得:
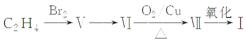
(1)有机物Ⅳ的分子式为________,含有官能团的名称为醚键和________。
(2)有机物Ⅴ的名称为________,其生成Ⅵ的化学方程式为(注明反应条件):_________________________________________________________________。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式
_______________________________________________________。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 mol NaOH
(4)反应①中反应物的原子利用率为100 %,请写出该反应的化学方程式
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的简略框架图。
| ① | ② | ④ | ⑤ | ||||||||||||||
| ③ | |||||||||||||||||
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)下列关于表中元素①与元素②的比较中正确的是:( )
A. 原子半径:①<② B. 电负性:②>①
C. 第一电离能:①>② D. 金属性:①<②
(3)指出表中元素③在周期表中的位置 ;其价电子排布式为 ;
(4)某基态原子X在第二能层上只有一个空轨道,则X是 (填写元素符号),其与④、⑤可分别形成三原子和五原子的溶剂Z和W,在Z分子中X的杂化方式为 ,W分子为: 分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com