
已知还原性:HSO >I-,氧化性:IO
>I-,氧化性:IO >I2。
>I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并标出电子转移的方向和数目。
□NaIO3+□NaHSO3―→□I2+□Na2SO4+□H2SO4+□H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为________________(填化学式)。
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式____________;当溶液中I-与I2的物质的量之比为53时,加入的NaIO3为________ mol。
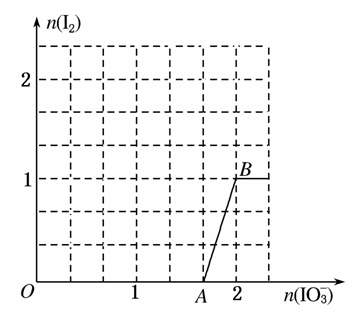
解析 (1)I元素的化合价由+5降低到0,S元素的化合价由+4升高到+6。根据化合价升降总数相等,配平反应方程式,标出电子转移的方向和数目。(2)由还原性HSO >I-可知,当NaHSO3溶液过量时IO
>I-可知,当NaHSO3溶液过量时IO 先被还原成I2,再被还原成I-。(3)OA段,随着IO
先被还原成I2,再被还原成I-。(3)OA段,随着IO 的量增加NaHSO3的量减少,IO
的量增加NaHSO3的量减少,IO 被还原成I-,至A点恰好完全反应,此时继续加入NaIO3,又发生NaIO3氧化I-的反应:IO
被还原成I-,至A点恰好完全反应,此时继续加入NaIO3,又发生NaIO3氧化I-的反应:IO +6H++5I-===3I2+3H2O。当I-与I2的物质的量之比为53时,设加入的NaIO3为x mol,根据转移电子数守恒,得5×2=
+6H++5I-===3I2+3H2O。当I-与I2的物质的量之比为53时,设加入的NaIO3为x mol,根据转移电子数守恒,得5×2=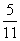 x×6+
x×6+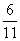 x×5,解得x=
x×5,解得x=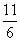 。
。
答案 (1)4NaIO3+10NaHS20e-O3===2I2+7Na2SO4+3H2SO4+2H2O
(2)NaI
(3)IO +5I-+6H+===3I2+3H2O 11/6
+5I-+6H+===3I2+3H2O 11/6


科目:高中化学 来源: 题型:
已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
利用“化学计量在实验中的应用”的相关知识进行填空
(1)在标准状况下,0.5mol任何气体的体积都约为 L。
(2)1.5mol H2SO4的质量是 ,所含分子数目为 。
(3)配制500mL 1mol/L HNO3溶液,需16mol/L HNO3溶液的体积为 mL.
(4)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为 ;
该金属元素的相对原子质量为 。
(5)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:10AgF+5Cl2+5H2 O===9AgCl+AgClO3+10HF+O2
O===9AgCl+AgClO3+10HF+O2
下列关于该反应的叙述不正确的是( )
A.该反应中,氧化剂与还原剂物质的量之比为95
B.当反应中有1 mol电子转移时,被还原氯气物质的量为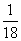 mol
mol
C.每产生1 mol O2时,被氧元素还原的氯气物质的量为2 mol
D.参加反应的水有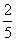 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是( )
A.25 ℃时, pH=12的无色溶液:K+、Br-、SO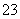 、SiO
、SiO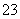
B.与铝粉反应放出氢气的溶液:HCO 、K+、Na+、SO
、K+、Na+、SO
C.使石蕊溶液显红色的溶液:Na+、NH 、Cl-、S2O
、Cl-、S2O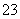
D.25 ℃时,由水电离出来的c(H+)=1×10-13 mol/L的溶液:Ba2+、Cl-、AlO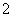 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是( )
| 共价键 | H—H | F—F | H—F | H—Cl | H—I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g)===2HF(g)
ΔH=-25 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO 。其过程如下:
。其过程如下:
mCeO2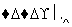 (m-x) CeO2·xCe+xO2
(m-x) CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2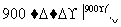 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
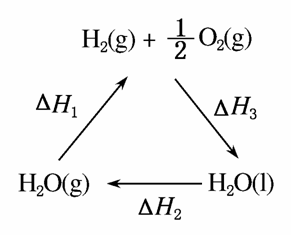
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.上图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为__________。
(2)与OH-互为等电子体的一种分子为________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是____________;1 mol乙醛分子中含有的σ键的数目为__________。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____________________________________________________________。
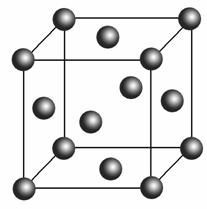
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物n g,跟足量金属钠反应生成V L H2,另取n g该有机物与足量碳酸氢钠作用生成V L CO2(相同状况下),该有机物分子中含有的官能团为( )
A.含一个羧基和一个羟基
B.含两个羧基
C.只含一个羧基
D.含两个羟基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com