
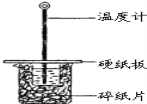
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
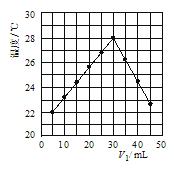
(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
【答案】(1)D (2)ABD (3)ΔH1>ΔH2=ΔH3 (4)1.5mol/L
【解析】
试题分析:(1)A.该实验也可在保温杯中进行,A正确;B.图中实验装置缺少环形玻璃搅拌棒,B正确;C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失,C正确;D.若将盐酸体积改为60mL,两次实验所求得中和热相等,D错误,答案选D。
(2)A.实验装置保温、隔热效果差,导致热量损失,测量值减小,A正确;B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中导致热量损失,测量值减小,B正确;C.量取NaOH溶液的体积时仰视读数,实际量取的体积增加,测量值偏大,C错误;D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度,导致氢氧化钠减少,放出的热量减少,测量值减小,D正确。答案选ABD。
(3)弱电解质中才电离平衡,电离吸热,所以实际放出的热量减少,放热越少,△H越大,则ΔH1、ΔH2、ΔH3的大小关系为ΔH1>ΔH2=ΔH3;
(4)温度最高时说明二者恰好完全反应,所以氢氧化钠的浓度为![]() =1.5mol。
=1.5mol。


科目:高中化学 来源: 题型:
【题目】二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂。工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛(HCHO)水溶液和甲醇(CH3OH)混合共热,反应原理如下:HCHO+2CH3OH![]() CH2(OCH3)2+H2O
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如表:
时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
CH2(OCH3)2 (mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
计算25~50min中CH2(OCH3)2的平均生成速率为___。
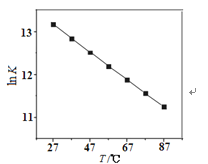
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图所示,判断该反应的△H___0(填“>”、“<”、“=”)。
(3)假设在密闭容器中发生上述反应:
①达到平衡时下列措施能提高HCHO转化率的是___。
A.及时从反应体系中分离出CH2(OCH3)2
B.升高反应体系的温度
C.再添加适量甲醇
D.再添加一定量甲醛
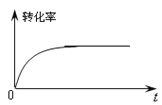
②下图是催化剂作用下甲醇转化率随时间变化的趋势曲线图。请在图中用虚线画出相同条件下,不使用催化剂时转化率随时间变化的曲线。___
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响。欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如表:
影响因素 实验号 | 甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率(r/min) |
1 | ___ | 70 | 2.5 | 30 |
2 | 1.0 | ___ | ___ | ___ |
3 | 2.5 | ___ | ___ | 80 |
①请在上表空格中填入剩余的实验条件数据。
②在研究过程中发现,甲醛(HCHO)的滴加速率过慢或过快均会使CH2(OCH3)2产率降低。请结合该反应的合成机理:HCHO![]() HOCH2OCH3
HOCH2OCH3![]() CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
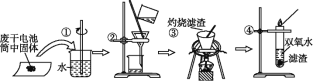
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
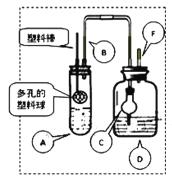
(1)请写出锌与硫酸反应产生SO2的化学方程式_______。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________。
(3)长导管B的作用是______,如果没有这个设计,最终测定的临界浓度会_______。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO![]() 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO![]() 的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
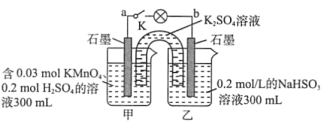
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com