
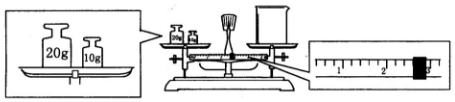
分析 (1)根据实验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等来选择实验所需仪器;
(2)天平平衡原理为m(左)=m(右)+m(游码),据此计算烧杯实际质量;依据m=CVM计算需要溶质的质量;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.必须用到的仪器有:天平、药匙、玻璃棒、烧杯、量筒、胶头滴管、容量瓶,配制 1.0mol/L 的 NaOH 溶液 240mL,应选择250mL容量瓶,所以还缺少的仪器:250mL容量瓶;
故答案为:250mL容量瓶;
(2)左盘内质量为30g,游码的数值为2.6g,所以烧杯的实际质量为30g-2.6g=27.4g;
配制 1.0mol/L 的 NaOH 溶液 240mL,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量m=1.0mol/L×0.25L×40g/mol=10.0g;
故答案为:10.0;27.4g;
(3)①没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线的,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:④.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,只要掌握实验的操作步骤即可完成,注意托盘天平使用方法和原理.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 催化剂是影响化学反应速率的本质因素 | |
| B. | 当反应体系容积不变时,减小反应物的量肯定能降低反应速率 | |
| C. | 可逆反应达到反应限度时,化学反应速率为0 | |
| D. | 化学反应速率可用单位时间内反应物的浓度变化量来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
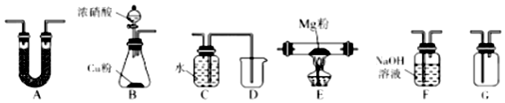
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
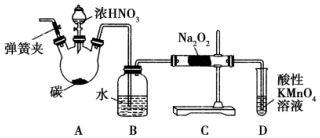 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
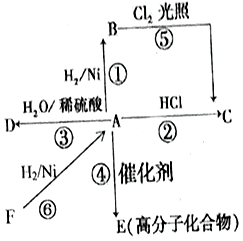 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com