
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
【答案】B
【解析】试题分析:A.增大压强,单位体积内的活化分子数增加,化学反应速率加快,由于分子总数也增加,所以活化分子百分数不变,温度不变,化学平衡常数不变,错误;B.升高温度,使分子的总能量增加,单位体积内的活化分子数增加,活化分子百分数增加,化学反应速率加快,由于该反应发生伴随能量变化,所以化学平衡常数会发生变化,正确;C.使用催化剂,由于改变了反应途径,降低了反应的活化能,所以单位体积内的活化分子数增加,由于分子总数不变,所以活化分子的百分数增加,化学反应速率加快,催化剂不能改变化学平衡常数,错误;D.多充O2,使反应物的浓度增大,活化分子数增大,活化分子的百分数不变,反应速率加快,但由于温度不变,所以化学平衡常数不变,错误。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:

提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
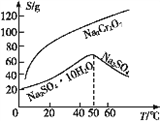
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图。下列有关说法正确的是

A. 该电池的总反应为C+O2=CO2
B. 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C. 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D. 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.铁和稀硫酸反应 2Fe + 6H+ == 2Fe3+ + 3H2↑
B.向硫酸钠溶液中滴加氯化钡溶液Ba2+ + SO42― == BaSO4↓
C.氯水加入到溴化钾溶液中Br―+ Cl2 == Br2 + Cl―
D.碳酸钙溶于稀盐酸 CO32― + 2H+ == H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
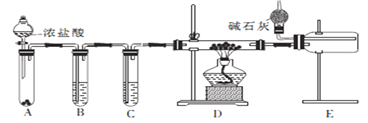
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
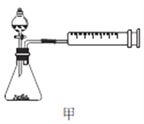
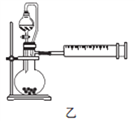
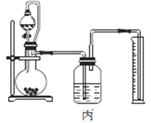
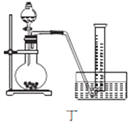
从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是
A.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B.Na2CO3比NaHCO3热稳定性强
C.Na2CO3不能与澄清石灰水反应
D.Na2CO3和NaHCO3均可与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com