
| A. | 反应温度 | B. | 使用催化剂 | C. | 压强 | D. | 反应物性质 |
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜一锌原电池中,铜是原电池的阴极 | |
| B. | 用电解法精炼粗铜时,粗铜作阴极 | |
| C. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释 pH=4的醋酸,溶液中c(OH-)离子的浓度降低 | |
| B. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH=1 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中滴入AgNO3溶液 | B. | 氢气还原氧化铜 | ||
| C. | 铁片置于CuSO4溶液中 | D. | 一氧化碳的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g)(正反应放热) | B. | N2 (g)+O2(g)?2NO(g) (正反应吸热) | ||
| C. | 2SO2(g)+O2(g)?2SO3(g)(正反应放热) | D. | C(s)+H2O(g)?CO(g)+H2(g) (正反应吸热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
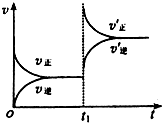 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)=2HI(g)△H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示.
698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)=2HI(g)△H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com