
高温条件下反应达到平衡时的平衡常数 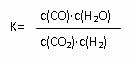 。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
A.反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 kJ/mol
CO2(g)+H2(g) △H<0 kJ/mol
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应的正反应为放热反应
科目:高中化学 来源: 题型:
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.金属性:Y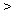 Z B 氢化物的沸点:
Z B 氢化物的沸点: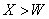
C.离子的还原性: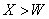 D 原子及离子半径:
D 原子及离子半径: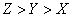
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验对应的结论不正确的是 ( )
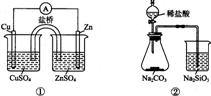
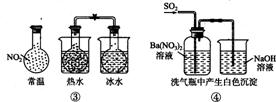
A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si
C.③能说明 △H<0 D.④中自色沉淀为BaS04
△H<0 D.④中自色沉淀为BaS04
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方
程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=+57.4 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石一定比石墨稳定
C.已知2H2O(g)=2H2(g)+O2(g) △H=+483.6 kJ·mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解
D. 已知C(s)+O2(g)=CO2(g) △H=a kJ·mol-1,2C(s)+O2(g)=2CO(g), △H=b kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) △H=(2a﹣b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A.反应开始时,反应速率:甲<乙<丙
B.平衡时,甲中和丙中H2的转化率均是
 60%
60%
C.平衡时,c(CO2)丙=2c(CO2)甲
D.平衡时,乙中CO2的体积分数大于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的热化学方程式
(1)在25℃,101 Kpa 下1 mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8 kJ,试写出表示乙醇燃烧的热化学方程式:____
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。已知:N2(g)+2O2 (g)=2NO2(g) △H=+67.7kJ/mol
2N2H4(g)+2NO2 (g)=3N2(g)+4H2O(g)△H= 一1135.7kJ/ mol
则肼完全燃烧的热化学方程式为 。
(3)高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO(g)= Fe(s)+ CO2(g) △H>0。
①此反应的平衡常数表达式为 ;
②温度升高平衡常数K值 (填“增大”、“减小”、或“不变”)
③已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“不是” )处于化学平衡状态,此时化学反应速率是
)处于化学平衡状态,此时化学反应速率是
v正 v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选用的相关仪器、用品不符合实验要求的是( )
| A | B | C | D |
| 准确量取19.01 mL水 | 新制氯 | 测定0.1 mol/L Na2CO3溶液的pH |
|
| 25 mL酸式滴定管 | 带玻璃塞的棕色细口瓶 | 镊子、pH试纸、表面皿 | 分液漏斗、烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)Fe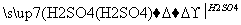 H2
H2 Cu
Cu
(2)CuO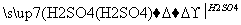 CuSO4
CuSO4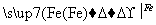 Cu
Cu
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
A.消耗铁的质量不同
B.消耗硫酸的质量相同
C.生成硫酸亚铁的质量相同
D.消耗氧化铜的质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
下列物质中,在①O3和②Zn/H2O的作用下能生成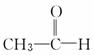 的是
的是
( )
A.CH3—CH2—CH===CH—CH3
B.CH2===CH2
C.CH2CCH3CH3
D.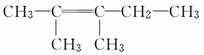
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com