
| A.KW随溶液温度、浓度的改变而改变 |
| B.凡是氧化还原反应,都是放热反应 |
| C.对已达到化学平衡的反应,改变压强,平衡一定改变 |
| D.弱电解质的电离程度,与温度、浓度均有关系 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
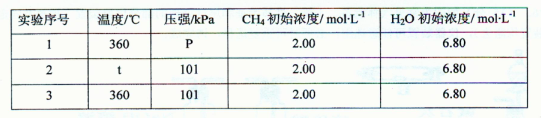
 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
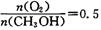 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是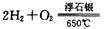
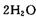 ,则另一步是____________ (写化学方程式)。
,则另一步是____________ (写化学方程式)。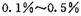 的HCHO可用于杀菌消毒,其原因是________。
的HCHO可用于杀菌消毒,其原因是________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
| A.v(正)>v(逆) | B.v(正)<v(逆) |
| C.v(正)=v(逆) | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降 |
| B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小 |
| C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢 |
| D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
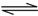 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。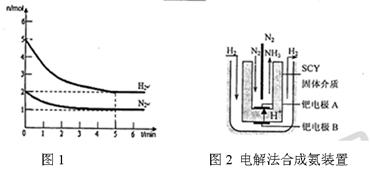
 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是 。
上发生的电极反应式是 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
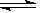 N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是( )
N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是( )| A.①②③④ | B.①②③ | C.①② | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
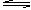 pC(g)+qD(g);ΔH<0。下列结论中正确的是( )
pC(g)+qD(g);ΔH<0。下列结论中正确的是( ) 增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q
增大1倍,此时A的浓度变为原来的0.48 倍,则m+n>p+q 平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n
平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶n查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(气)+D(气),以下能说明已达平衡状态的是
C(气)+D(气),以下能说明已达平衡状态的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com