
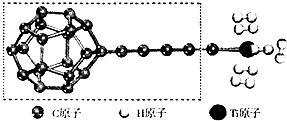
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
分析 (1)①根据基态Ti3+的核外电子排布式确定其未成对电子数;
②具有相同的电子数和原子数的微粒互为等电子体;阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
③非金属的非金属性越强其电负性越大;
(2)①电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)根据C原子是成键类型判断;
(4)分子间氢键数目越多,则沸点越高;CH4分子间没有氢键,HF分子间只能形成链状结构;
(5)利用均摊法计算该化合物的化学式,K+ 处于晶胞中心,只有一个,F-处于晶胞棱边中心,共有12个.
解答 解:(1)①基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,其未成对电子数是1,故答案为:1;
②具有相同的电子数和原子数的微粒互为等电子体,则BH4-的等电子体为NH4+;Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键;
故答案为:NH4+;C;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)①Li+和H-的电子层结构相同,锂元素的原子序数大于氢元素,所以离子半径Li+<H-,故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,故答案为:Mg;
(3)图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种;
故答案为:3;
(4)分子间氢键数目越多,则沸点越高,已知H2O分子间氢键数比HF多,所以H2O沸点高;CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,
故答案为:H2O分子间氢键数比HF多,所以H2O沸点高;BC;
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心,根据均摊法可知,每个晶胞含有Mg2+:8×$\frac{1}{8}$8=1个,K+:1个,F-:12×$\frac{1}{4}$=3个,故化学式为KMgF3,K+ 处于晶胞中心,只有一个,F-处于晶胞棱边中心,共有12个,故每个K+与12个F-配位.
故答案为:KMgF3;12.
点评 本题考查物质结构和性质、晶胞的结构分析、杂化类型的判断,会根据构造原理书写原子或离子核外电子排布式,题目涉及的知识点较多,难度较大.


科目:高中化学 来源: 题型:选择题

| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)═0.225 mol/(L•min) | B. | v(H2O)═0.375 mol/(L•min) | ||
| C. | v(O2)═0.225 mol/(L•min) | D. | v(NH3)═0.450 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
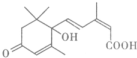
| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
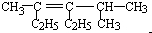 2,4-二甲基-3-乙基-3-己烯
2,4-二甲基-3-乙基-3-己烯 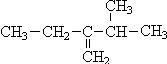 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯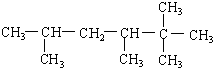 2,2,3,5-四甲基己烷.
2,2,3,5-四甲基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用来漂白馒头、银耳等食品 | |
| B. | 纯净的二氧化硅是制备光导纤维的原料 | |
| C. | 氢氧化铝可以用做耐火材料 | |
| D. | 四氧化三铁常用作红色油漆和涂料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com