
| 实验 | 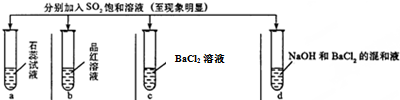 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
分析 二氧化硫为酸性氧化性,能够与水反应生成亚硫酸,溶液显酸性,二氧化硫具有漂白性能够使品红溶液褪色,二氧化硫与碱反应生成亚硫酸钠,亚硫酸钠与钡离子反应生成亚硫酸钡沉淀,具有还原性,水溶液中能够被氧化剂氧化生成硫酸根,硫酸根离子遇到钡离子反应生成硫酸钡沉淀,据此解答.
解答 解:①二氧化硫为酸性氧化性,能够与水反应生成亚硫酸,溶液显酸性,所以紫色石蕊变红;
二氧化硫具有漂白性能够使品红溶液褪色;
亚硫酸酸性弱酸盐酸,二氧化硫与氯化钡溶液不反应,故得不到白色沉淀;
二氧化硫二氧化硫与碱反应生成亚硫酸钠,亚硫酸钠与钡离子反应生成亚硫酸钡沉淀,所以产生白色的亚硫酸钡沉淀;
故选:c;
②A.将SO2通入BaCl2溶液中以后,再通入氨气,氨气与水反应生成一水合氨,一水合氨与亚硫酸反应生成亚硫酸根离子,亚硫酸根离子与钡离子反应生成亚硫酸钡沉淀,现象改变,故A选;
B.氯气具有强的氧化性,能够与二氧化硫、水反应生成硫酸,硫酸与钡离子反应生成硫酸钡白色沉淀,现象改变,故B选;
C.氢气不溶于水,且与二氧化硫不反应,通入氢气,现象不改变,故C不选;
D.氯化氢、二氧化硫、氯化钡不反应,所以通入氯化氢,现象不改变,故D不选;
故选:AB.
点评 本题考查了元素化合物知识,熟悉二氧化硫酸性氧化物、漂白性、还原性的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
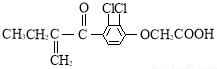 兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )| A. | 该有机物能发生酯化反应 | |
| B. | 该有机物属于芳香烃 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1 mol 该物质最多跟5mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62g白磷中含有2NA个白磷分子 | |
| B. | 1L 0.2mol/L Ba(NO3)2溶液中含有0.2NA个NO3- | |
| C. | 标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4mol HCl被氧化时,生成2NA Cl2 | |
| D. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,0H-数10-7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | X与Y能形成两种常见的化合物 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | B. | 离子半径:C(n+1)->Dn->A(n+1)+>Bn+ | ||
| C. | 单质还原性:B>A,氧化性:D>C | D. | 原子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
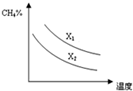 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com