
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
分析 A.酚羟基与碳酸氢钠溶液不反应;
B.含有苯环结构的蛋白质与硝酸发生颜色反应;
C.醛基可与氢氧化铜浊液或银氨溶液发生氧化还原反应;
D.根据R-OH~ROOCCH3的质量关系判断.
解答 解:A.酚类的酸性比碳酸弱,酚羟基与碳酸氢钠溶液不反应,故A错误;
B.含有苯环结构的蛋白质与硝酸发生颜色反应,变为黄色,故B正确;
C.醛基可与氢氧化铜浊液或银氨溶液发生氧化还原反应,故C正确;
D.由R-OH~ROOCCH3的质量关系可知,反应质量增大部分相当于“OCCH2”,式量为42,则有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物官能团的变化,把握有机反应的规律,难度不大.


科目:高中化学 来源: 题型:实验题
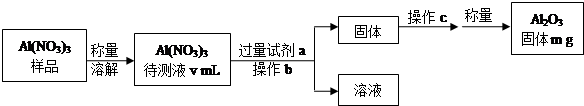
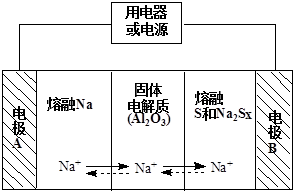
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数等于或大于3的元素一定是主族元素 | |
| B. | 原子最外层只有1个电子的元素一定是第IA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
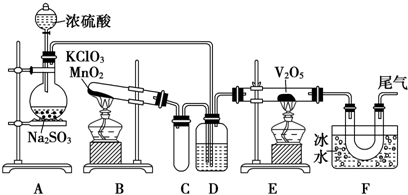
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
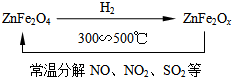 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
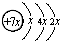 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com