
| ||
| ||
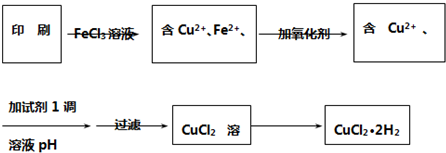
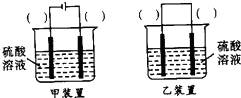
 ,故答案为:
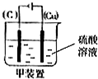
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、1 mol氧气的质量为32 g |
| B、标准状况下,0.5 molNO和0.5 mol O2的混合后体积约为22.4 L |
| C、CO2的摩尔质量为44 g/mol |
| D、1 L 2 mol?L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 蔗糖 | NaHCO3 | CO2 |
| B | 天然橡胶 | 石膏 | NH3?H2O | CH3CH2OH |
| C | 冰 | 王水 | H2SiO3 | Cl2 |
| D | 胆矾 | 水玻璃 | H2CO3 | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据维生素的溶解性可以将维生素分为脂溶性和水溶性两大类 |
| B、人体所需要的维生素都可以自身合成 |
| C、维生素C具有较强的还原能力,容易被氧化 |
| D、维生素的作用是维持细胞的正常功能、调节人体新陈代谢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
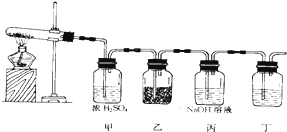
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com