
| A. | 10与19 | B. | 6与14 | C. | 11与17 | D. | 12与8 |
分析 一般的来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,先判断元素,再根据元素判断化学键类型.
解答 解:A、10号元素是稀有气体氖,性质稳定很难形成化合物,故A错误;
B、14号元素硅是非金属元素,6号元素碳是非金属元素,所以硅元素和碳元素之间易形成共价键,形成的化合物是共价化合物,故B正确;
C、11号元素钠是活泼金属元素,17号元素氯是非金属元素,钠元素和氯元素之间易形成离子键,形成的化合物是离子化合物,故C错误;
D、12号元素镁是金属元素,8号元素氧是活泼非金属元素,镁元素和氧元素之间易形成离子键,形成的化合物是离子化合物,故D错误.
故选B.
点评 本题考查了化学键的判断,难度不大,注意金属和非金属元素之间可能形成共价键,如氯化铝中只存在共价键,不含离子键.


科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、Cl- | B. | K+、NO3-、Cl-、I- | ||
| C. | Na+、Cl-、I-、SO42- | D. | NH4+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 mL 0.25 mol•L-1 MgCl2溶液 | B. | 200 mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1 NaCl溶液 | D. | 25 mL 0.5 mol•L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R是硫元素、则C是Na2SO3 | B. | 若R是硅元素、则C是Na2Si03 | ||
| C. | 若R是碳元素、则C是Na2CO3 | D. | 若R是氯元素、则C是NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2Mg+CO2═2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8mol/L,H2CO3的Ka1=4.3×10-7mol/L,Ka2=5.6×10-11mol/L,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NH4Cl中含有6.02×1023个NH4Cl分子 | |
| B. | 1.00mol NH4Cl中,${NH}_{4}^{+}$的数目为6.02×1023 | |
| C. | 欲配制1.00L 1.00mol•L-1NH4CL的溶液,可将53.5gNH4Cl溶于1.00L水中 | |
| D. | 1.00L 1.00mol•L-1 NH4Cl溶液中含有6.02×1023个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
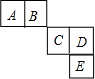 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )| A. | 元素A、B的所有氢化物中均只含有极性共价键 | |
| B. | 元素C、D形成的简单离子的电子总数不同 | |
| C. | 元素C、D、E形成的常见单质的熔沸点大小:E>D>C | |
| D. | C、D、E三种元素最高价氧化物对应的水化物中D的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率可用某时刻生成物的物质的量浓度的增加来表示 | |
| B. | 在同一反应中,用各种物质表示的化学反应速率的大小相等 | |
| C. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| D. | 若反应现象在短时间内出现,则反应速率快,反应现象若不出现,则该反应速率一定慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com