
【题目】已知热化学方程式2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
A.若该反应是放热反应,则a<0
B.用NO表示的平均化学反应速率v(NO)为0.16mol/(L·min)
C.达到化学平衡时,CO的转化率是80%
D.保持温度不变,若再向上述达到平衡的体系中充入2mol NO 和2mol CO,则反应重新达到平衡时c(N2)等于0.8mol/L
【答案】D
【解析】
在2L恒容密闭容器中充入2mol NO和2mol CO,保持温度不变,5min后反应达到平衡状态,此时c(N2)=0.4 mol/L,可知平衡时生成氮气为0.8mol,则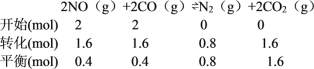
据此分析作答。
A. 放热反应的焓变为负,则若该反应是放热反应,a<0,A项正确;
B. 用NO表示的平均化学反应速率v(NO)为![]() =0.16mol/(L·min),B项正确;
=0.16mol/(L·min),B项正确;
C. 达到化学平衡时,CO的转化率是![]() ×100%=80%,C项正确;
×100%=80%,C项正确;
D. 保持温度不变,若再向上述达到平衡的体系中充入2mol NO和2mol CO,相当于体积减小一半,且该反应为气体体积减小的反应,则体积减小、压强增大,平衡正向移动,反应重新达到平衡时c(N2)大于0.8mol/L,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量A、B,发生如下反应:2A(g)+2B(g)![]() 3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数温度和压强的变化如表所示:

下列判断正确的是( )
A.g>f
B.△H<0
C.2.0MPa、300℃时,A的平衡转化率最小
D.1.5MPa、100℃时,B的平衡转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3)的流程图并进行了铁红性质实验。
(一)铁红制备的流程图
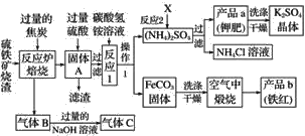
(1)写出焙烧中一氧化碳与氧化铁反应的化学方程式:______________________。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和____________(填仪器名称)。
(3)你认为对气体C最佳的处理方法是________(填选项序号)。
A.冷却后排入空气
B.燃烧后排放
C.再通入反应炉
(4)反应1的反应温度一般需控制在35 ℃以下,其目的是______________________________。
(5)反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:_____。
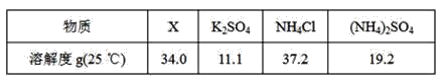
洗涤干燥得到硫酸钾晶体时,可选用下列______(选填序号,下同)洗涤剂
A.氯化钾饱和溶液
B.水
C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入________,振荡、静置,再向上层清液中滴加________,观察现象即可判断。
A.硝酸银溶液
B.过量的氯化钡溶液
C.过量的硝酸钡溶液
(二)铁红的性质实验
(1)实验装置
已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
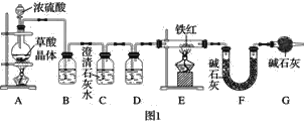
①实验前应先______________________。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是______、______(填字母编号)。
A.浓硫酸
B.澄清的石灰水
C.氢氧化钠溶液
③C装置的作用是________________________________。
(2)数据分析与计算:
用SDTQ600热分析仪对氧化铁和一氧化碳进行热反应分析,获得相关数据,绘制成管内剩余固体质量与反应温度的关系如图2。

已知铁的氧化物有FeO、Fe3O、Fe2O3,在一定的条件下,都能够逐步失去其中的氧,最终被还原为铁。
①800 ℃以上时,管内固体成分的化学式为___________。
②写出管内固体质量由48 g变为46.4 g时反应的化学方程式:________________________。
(3)实验评价
请指出问题讨论中实验装置的一个明显缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的铝箔5.01 g,加入足量的10%的稀盐酸,充分反应后收集到0.5 g氢气。
(1)被氧化的金属铝的质量为多少克?__________________
(2)参加反应的稀盐酸的质量为多少克?____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Al与NaOH溶液反应:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
B.Fe(OH)2与足量稀硝酸反应:Fe(OH)2+2H+=Fe2++2H2O
C.Na2S碱性溶液中通入SO2生成Na2S2O3:3SO2+S2-=2S2O![]()
D.KMnO4酸性溶液与SO2反应:2MnO![]() +5SO2+4OH-=2Mn2++5SO
+5SO2+4OH-=2Mn2++5SO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(![]() ),下列说法正确的是( )
),下列说法正确的是( )
A.与环戊醇互为同系物
B.分子中所有碳原子共平面
C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同
D.可用碳酸钠溶液鉴别乙酸和M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com