

分析 (1)①SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,吸收塔不用水而用98.3%浓硫酸吸收SO3的原因是在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收;
(2)A.橡胶硫化所用到的为单质硫;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C.铅蓄电池中需要用到硫酸和硫酸铅;
D.硫酸制硫磺理论上用较强还原剂能实现,但实际上成本太高,制备大量硫磺不可取;
(3)根据SO2为酸性氧化物,与碱反应生成盐和水,亚硫酸盐易被空气氧化成硫酸盐书写;
(4)根据反应的转化关系式计算,关系式为:S~SO2~SO3~H2SO4;
解答 解:(1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,避免产生酸雾从而降低吸收效率;
故答案为:热交换器;增加SO3与浓硫酸的接触面积,有利于SO3的吸收;避免产生酸雾从而降低吸收效率;
(2)A.橡胶硫化所用到的为单质硫,故A错误;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,故B正确;
C.铅蓄电池中需要用到硫酸和硫酸铅,故C正确;
D.硫酸制硫磺理论上用较强还原剂能实现,但实际上成本太高,制备大量硫磺不可取,故D错误;
故选:BC;
(3)SO2为酸性氧化物,与碱反应生成盐和水,化学方程式为:2NH3•H2O+SO2=(NH4)2SO3+H2O,亚硫酸盐易被空气氧化成硫酸盐,
故答案为:2NH3•H2O+SO2=(NH4)2SO3+H2O,2(NH4)2SO3+O2═2(NH4)2SO4;
(4)根据反应的转化关系式计算,关系式为:S~SO2~SO3~H2SO4,设则制取1吨98%的硫酸需这种硫矿m吨,
S~~~~~~~~~~~~~~H2SO4
32 98
m吨×a%×(1-b%)×c% 1吨×98%
解出 m=$\frac{32×98%}{98×a%×(1-b%)×c%}$ 化简为 $\frac{3200}{ac(1-b%)}$;
故答案为:$\frac{3200}{ac(1-b%)}$或 $\frac{32×98%}{98×a%×(1-b%)×c%}$.
点评 本题是对化学与技术及工业生产的考查,把握制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 将化学能转变为电能的装置叫做原电池 | |
| B. | 乙醇和沼气都是可再生能源 | |
| C. | CO2是造成酸雨的主要原因之一 | |
| D. | 质子数相同而中子数不同的同一元素的不同原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
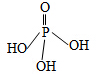 (1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为
(1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为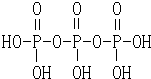 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2OHCHOHCHOHCHO | B. | CH2OHCHOHCHOHCH2CHO | ||
| C. | CH2OHCHO | D. | CH2OH(CHOH)3COCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题:
现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题: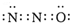 ,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.
,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入盐酸溶液 HCl+NH3═NH4Cl | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Y>Z | B. | 氢化物的稳定性:X>W | ||
| C. | 离子的还原性:X>W | D. | 离子半径:Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com