
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )

A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
科目:高中化学 来源: 题型:
【题目】如图A、B、C、D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味。
![]()
在有机物中,凡是具有—CHO结构的物质,具有如下性质:
①与新制氢氧化铜悬浊液反应,产生砖红色沉淀;
②在催化剂作用下,—CHO被氧气氧化为—COOH,即![]() 。
。
根据以上信息及各物质的转化关系完成下列各题。
(1)B的化学式为_________,C的结构简式为__________。
(2)其中能与新制氢氧化铜悬浊液反应产生砖红色沉淀的物质有_________(填名称)。
(3)C→D的化学方程式为______________。
(4)C + E→ F的化学方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入1.0 mol CO和2.0 mol H2O(g)发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
A.0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
B.1.0 mol CO+2.0 mol H2O(g)+0.5 mol He
C.1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.![]() 下,在
下,在![]() 稀溶液中,加水,
稀溶液中,加水,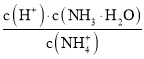 的值不变
的值不变
D.在NaHS溶液中,滴入少量![]() 溶液产生黑色沉淀,
溶液产生黑色沉淀,![]() 水解程度增大,pH增大
水解程度增大,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()

A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com