
【题目】用间接电化学法可对大气污染物 NO 进行无害化处理,其工作原理如图所示。下列说法正确的是 ( )
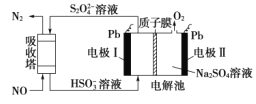
A.电极I为阴极,电极反应式为2H2O+2e- = 2OH-+H2↑
B.电解时 H+ 由电极II向电极I迁移
C.吸收塔中的反应为2NO+2S2O![]() +2H2O =N2 +4HSO
+2H2O =N2 +4HSO![]()
D.每处理1mo1NO,可同时得到32gO2
【答案】BC
【解析】
HSO3-在电极I上转化为S2O![]() ,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO
,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO![]() +2e-+2H+═S2O
+2e-+2H+═S2O![]() +2H2O;H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,电极Ⅱ为阳极。
+2H2O;H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,电极Ⅱ为阳极。
A.HSO3-在电极I上转化为S2O![]() ,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO
,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO![]() +2e-+2H+═S2O
+2e-+2H+═S2O![]() +2H2O,故A错误;
+2H2O,故A错误;
B.电极I为阴极,则电极Ⅱ为阳极,电解池中阳离子向阴极移动,所以电解池中H+通过质子膜向电极I处移动,故B正确;
C.吸收塔中通入NO和S2O42-离子反应,生成N2和HSO![]() ,所以反应方程式为:2NO+2S2O
,所以反应方程式为:2NO+2S2O![]() +2H2O=N2+4HSO
+2H2O=N2+4HSO![]() ,故C正确;
,故C正确;
D.电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,每处理1 mol NO,则转移电子数为1mol×2=2mol,根据电子转移守恒,则产生O2的物质的量为2mol×![]() =0.5mol,质量为0.5mol×32g·mol-1=16g,故D错误;
=0.5mol,质量为0.5mol×32g·mol-1=16g,故D错误;
故选BC。


科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出⑥的元素符号: ____________,画出![]() 的原子结构示意图________________;
的原子结构示意图________________;
(2)写出③的单质在空气中燃烧后的产物与二氧化碳反应的化学方程式:___________________________________;该反应每生成1mol气体转移_______个电子。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________________,碱性最强的是___________________,呈两性的氢氧化物是___________________;
(4)写出单质③在空气中燃烧生成产物的电子式___________________;
(5)用电子式表示出④的氯化物的形成过程_____________________________________;
(6)写出实验室制取⑧的单质的化学方程式 ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,X与Q同族,Y和Z的离子与Ar原子的电子结构相同。
(1)Q的最高价氧化物中Q的杂化类型为___,分子中含有___个σ键,___个π键。
(2)X的氢化物分子的立体构型是___,属于__分子(填“极性”或“非极性”);它与R形成的化合物可作为一种重要的陶瓷材料,其化学式是___。
(3)Q分别与Y、Z形成的共价化合物的化学式是___和___;Q与Y形成的分子的电子式是__,属于___分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
| |
①配制0.l0mol/L NaOH溶液 | ②除去CO中的CO2 |
| |
③苯萃取碘水中的I2,分出水层后得到I2的操作 | ④记录滴定终点读数为12.20mL |
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
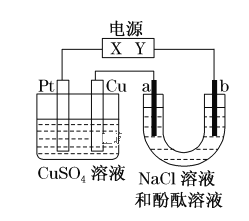
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
![]()
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能燃烧,其产物一定为二氧化碳和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com