
| A. | x+y<z | B. | 平衡正向移动 | C. | A的转化率降低 | D. | C的物质的量增大 |
分析 保持温度不变,将容器的体积扩大两倍,若平衡不移动,A的浓度应该为0.30mol/L,实际A的浓度变为0.35mol/L,说明平衡向生成A的方向移动,即向逆反应移动,逆向为气体体积增大的反应,据此结合化学平衡的影响因素对各选项判断.
解答 解:保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.30mol/L,实际A的浓度变为0.35mol/L,说明平衡向生成A的方向移动,即向逆反应移动,
A.平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,即x+y>z,故A错误;
B.根据分析可知,平衡向逆反应移动,故B错误;
C.平衡向生成A的方向移动,即逆反应移动,A的转化率降低,故C正确;
D.平衡向逆反应移动,C的物质的量减小,故D错误;
故选C.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确扩大体积后A的浓度是增大了为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
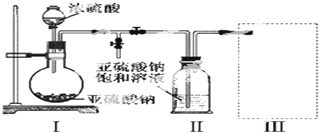
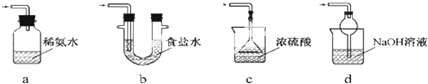
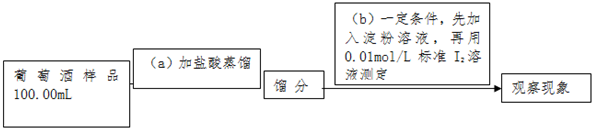
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
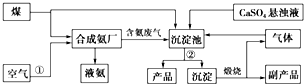
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀, 4.黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
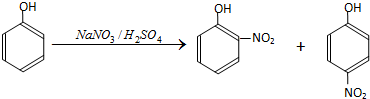
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com