
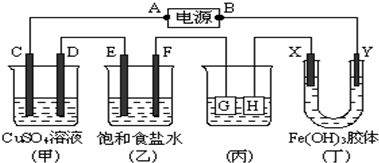
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连;
(2)根据电解原理来书写电池反应;
(3)欲用丙装置给铜镀银,G为阳极应该是银,电镀液的主要成分是AgNO3溶液,根据Ag++e-=Ag计算;
(4)根据异性电荷相吸的原理以及胶体的电泳原理来回答.
解答 解:(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,故答案为:正极;
(2)电解硫酸铜溶液时的阳极是氢氧根离子放电,反应式为4OH--4e-=O2↑+2H2O,阴极是铜离子,放电反应式为Cu2++2e-=Cu,故答案为:4OH--4e-=O2↑+2H2O;
(3)欲用丙装置给铜镀银,G为阳极应该是银,电镀液的主要成分是AgNO3溶液,根据Ag++e-=Ag,外电路中通过0.1mol电子时,生成0.1mol的银,质量为:10.8
g,故答案为:银;AgNO3;10.8;
(4)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:X极附近颜色变浅,Y极附近颜色加深;说明Fe(OH)3胶体中的胶粒带正电荷.
点评 本题是一道电化学综合知识题目,可以根据所学知识进行回答,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 (1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com