
| A. | c(Z)=0.3 mol•L-1 | B. | c(Y2)=0.35 mol•L-1 | ||
| C. | c(X2)=0.15 mol•L-1 | D. | c(Z)=0.4 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(g)+Y2(g)?2Z(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(g)+Y2(g)?2Z(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,故ABC正确、D错误.
故选D.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


科目:高中化学 来源: 题型:填空题
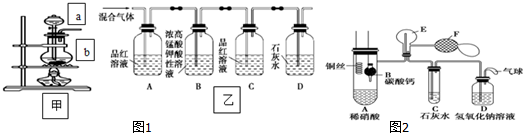
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g(H218O)含有的原子总数为3NA | |
| B. | 标准状况下,4.2g CH2=CH2气体中所含有的碳原子总数为0.3NA | |
| C. | 将0.1mol的Cl2通入1L水中转移的电子数目为0.1NA | |
| D. | 0.1mol/LAl2(SO4)3溶液中含有的Al3+总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
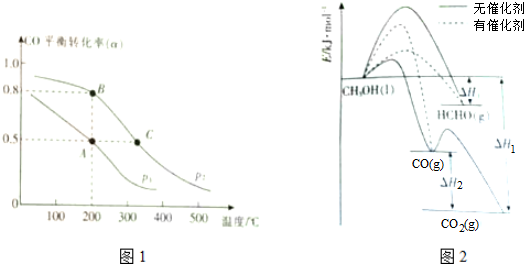
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com