
| A.浓硝酸 |
| B.硫酸亚铁 |
| C.工业盐酸 |
| D.稀溴水 |
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸和浓硝酸都具有氧化性 |
| B.铜和浓硫酸的反应属于置换反应 |
| C.在铜和浓硝酸的反应中,硝酸只发挥了氧化性,没有体现酸性 |
| D.可用铝或铁制容器盛装稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均为+2价 | B.均为+3价 |
| C.+2、+3价 | D.+2、+4价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铝 | B.硫酸铜 | C.硝酸钠 | D.稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.胶体粒子能透过滤纸,但不能透过半透膜 |
| B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
| C.只有胶体粒子能做布朗运动 |
| D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 |
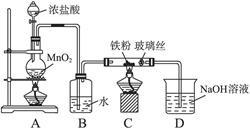
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com