(2011?门头沟区模拟)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
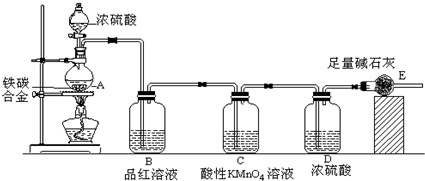
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②
常温下Fe遇浓硫酸发生钝化
常温下Fe遇浓硫酸发生钝化
.
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
.
(3)B中的现象是:
品红溶液褪色
品红溶液褪色
;C的作用是:
除尽反应产物中的SO2气体
除尽反应产物中的SO2气体
.
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.则铁碳合金中铁的质量分数为
(写表达式).
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:
装置内的CO2难以赶尽,导致E质量增重偏小
装置内的CO2难以赶尽,导致E质量增重偏小
.
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)
SO2不一定能全部被品红KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O
SO2不一定能全部被品红KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O
.




 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案