
 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑; 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。 8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑、②Na2CO3+Al2O3 2NaAlO2+CO2↑、③Cr2O72-+H2O
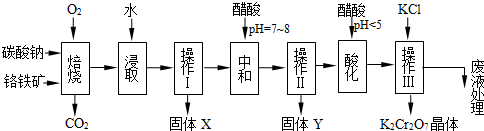
2NaAlO2+CO2↑、③Cr2O72-+H2O 2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。
2CrO42-+2H+。氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸。 2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。
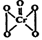
2CrO42-+2H+可知,加入酸,溶液中氢离子浓度增大,平衡左移,所以目的是使CrO42-转化为Cr2O72-。 可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。
可知,该化合物中Cr元素的化合价仍然是+6价,其中氧元素的化合价有4个-1价的,1个-2价的,因此该反应前后元素的化合价均没有发生变化,所以反应不是氧化还原反应。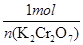 =
=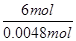
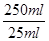 ×0.0008mol=0.008mol
×0.0008mol=0.008mol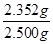 ×100%=94.1%
×100%=94.1%

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 试剂 | 方法 |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 澄清石灰水 | 洗气 |
| C | 氧化铁 | 二氧化硅 | 氢氧化钠溶液 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
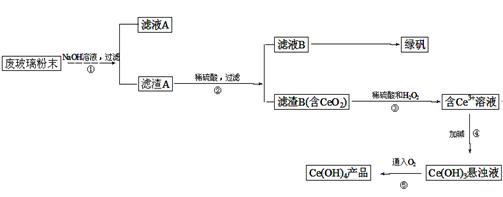
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
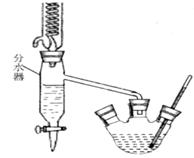
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

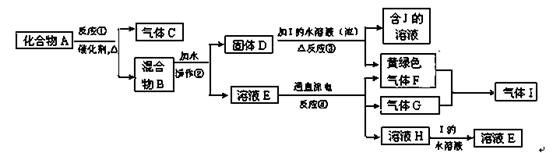
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
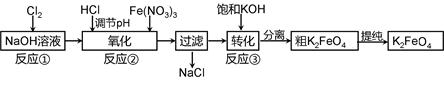
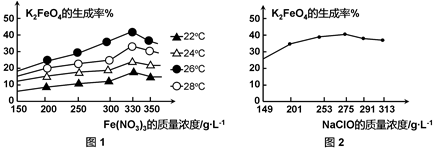
 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①→③→⑤→②→④ | B.②→①→③→④→⑤ |
| C.②→④→①→③→⑤ | D.③→①→②→⑤→④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com