
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
【答案】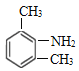 AD ClCH2COCl+
AD ClCH2COCl+
![]()
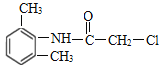 +HCl
+HCl ![]() 、
、![]() 、
、![]() 、
、![]()
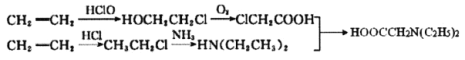
【解析】
A是乙烯:CH2=CH2,CH2=CH2与HClO发生加成反应产生B:HOCH2CH2Cl,B含有醇羟基,被氧化产生C:ClCH2COOH,ClCH2COOH与SOCl2发生反应产生D是ClCH2COCl;E分子式是C8H10,符合苯的同系物通式,根据目标生成物M的分子结构可知E是间二甲苯,结构简式为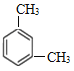 ,E与浓硝酸、浓硫酸混合加热发生取代反应产生F:
,E与浓硝酸、浓硫酸混合加热发生取代反应产生F: ;F与Fe在HCl存在时将—NO2转化为—NH2,F被还原生成G:
;F与Fe在HCl存在时将—NO2转化为—NH2,F被还原生成G: ;D与G发生取代反应产生H:
;D与G发生取代反应产生H: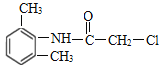 ,H与二乙胺发生取代反应产生M:
,H与二乙胺发生取代反应产生M: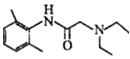 。
。
(5)乙烯与HClO发生加成反应产生HOCH2CH2Cl,HOCH2CH2Cl被氧化产生ClCH2COOH;乙烯与HCl发生加成反应产生CH3CH2Cl,CH3CH2Cl与NH3发生取代反应产生二乙胺[HN(CH2CH3)2],二乙胺[HN(CH2CH3)2]与ClCH2COOH发生取代反应产生X,结构简式为HOOCCH2N(CH2CH3)2,据此解答。
根据上述分析可知A是CH2=CH2,B是HOCH2CH2Cl,C是ClCH2COOH,D是ClCH2COCl;E是 ,F是
,F是 ,G是
,G是 ,H是
,H是 。
。
(1)化合物G的结构简式为 ;
;
(2) A.化合物A是乙烯,B是HOCH2CH2Cl ,A→B的反应为加成反应,不属于氧化反应,A错误;
B.化合物G 中含有-NH2,能与浓盐酸电离产生的H+形成配位键,从而二者结合形成盐酸盐,B正确;
中含有-NH2,能与浓盐酸电离产生的H+形成配位键,从而二者结合形成盐酸盐,B正确;
C.化合物H中含有Cl原子、酰胺键,发生水解反应产生HCl及羧基都可以与NaOH反应,根据其结构可知,1molH与NaOH溶液反应最多消耗2molNaOH,C正确;
D.根据局麻药M的结构简式可知M的分子式为C14H22N2O,D错误;
故合理选项是AD;
(3)化合物D与G发生取代反应产生H的化学方程式为:ClCH2COCl+ →
→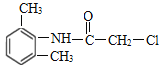 +HCl;
+HCl;
(4)化合物F 的同分异构体满足下列条件:ⅰ.能与FeCl3溶液发生显色反应,说明含有酚羟基;ⅱ.能发生银镜反应,说明含有醛基;ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子,说明两个取代基在苯环上相对位置,则其可能的结构为
的同分异构体满足下列条件:ⅰ.能与FeCl3溶液发生显色反应,说明含有酚羟基;ⅱ.能发生银镜反应,说明含有醛基;ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子,说明两个取代基在苯环上相对位置,则其可能的结构为![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(5)乙烯与HClO发生加成反应产生HOCH2CH2Cl,HOCH2CH2Cl被氧化产生ClCH2COOH;乙烯与HCl发生加成反应产生CH3CH2Cl,CH3CH2Cl与NH3发生取代反应产生二乙胺[HN(CH2CH3)2],二乙胺[HN(CH2CH3)2]与ClCH2COOH发生取代反应产生X,结构简式为HOOCCH2N(CH2CH3)2。故烃A为原料制备化合物X的合成路线是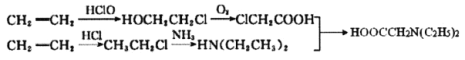 。
。


科目:高中化学 来源: 题型:
【题目】“反向燃烧”可将二氧化碳变为燃料。回答下列问题:

(已知甲烷的标准燃烧热ΔH=-890 kJ·mol-1) 。
(1)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式:_________________________;
②该总反应的热化学方程式为:___________________________,
(2)利用CO2与H2反应可制备CH4。
已知氢气的标准燃烧热ΔH=-286 kJ·mol-1 ;H2O(g) = H2O (l),ΔH=-44kJ·mol-1;
则二氧化碳与氢气反应生成甲烷和水蒸气的热化学方程式为_____________________;
该反应能自发的条件是__________(填高温或低温)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为应对全球石油资源口益紧缺。提高煤的利用效率,我国开发了煤制烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2):C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol该反应在高温下能自发进行,理由是_____________。
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:
主反应I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
反应II.CO(g)+H2(g)![]() C(s)+H2O(g)
C(s)+H2O(g)
①在容积均为VL的甲、乙、丙三个密闭容器中分别充入amolCO和2 amolH2,三个容器的反应温度分别为T1、T2、T3(T1<T2<T3)且恒定不变,若只发生反应I,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时三个容器中一定处于化学平衡状态的是_____(填“T1”、“T2”或“T3”):该温度下的化学平衡常数为_____(用a、V表示)。

②为减弱副反应的发生,下列采取的措施合理的是______。
A.反应前加入少量的水蒸气 B.增压
C.降低反应温度 D.使用合适催化剂,提高甲醇的选择性
(3)由甲醇制烯烃
主反应:i.2CH3OH![]() C2H4+2H2O
C2H4+2H2O
ii.3CH3OH![]() C3H6+3H2O
C3H6+3H2O
副反应:iii.2CH3OH![]() CH3OCH3+H2O
CH3OCH3+H2O
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)


下列说法不正确的是_________。
A.反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B.使用Cat.2反应2h后乙烯和内烯的选择性下降,可能的原因是生成副产物二甲醚
C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D.不管使用Cat.1还是使用Cat.2都能提高活化分子的百分数
(4)已知:2CrO42-+2H+![]() Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下
Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下

①a为电源的________(填“正极”或“负极”)
②该制备过程总反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林的结构简式如右图: 
根据这一信息,回答下列问题:。
(1) 写出阿司匹林的分子式:______________________________________
(2) 根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是 (_______)
A、氢氧化钠溶液 B、硫酸钠溶液 C、碳酸钠溶液 D、稀硫酸
(3) 阿司匹林是一种人工合成药物,化学上用水杨酸与乙酸酐(CH3CO)2O反应来制取阿司匹林。请用化学反应方程式表示这个过程:__________________________________________________________
(4)阿司匹林与NaOH反应可以得到可溶性钠盐,有比阿司匹林更好的疗效。请写出此反应的方程式:__________________________________________________________
(5) 有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱。请回答:
①某同学胃酸过多,应选用的药物是________(填序号)。
抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药与胃酸反应的化学方程式:_________________________________________________________
②由于具有兴奋作用,国际奥委会严禁运动员服用的药物是________(填序号)。
③从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是________(填序号)。
④滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚交实验装置取得重大突破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述中错误的是
A.氘原子的相对原子质量为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CO和CO2的混合气体20克,其在标准状况下的体积为11.2L。据此回答下列问题:
(1)该混合气体总的物质的量为______,其平均摩尔质量为_______。
(2)混合气体中碳原子的个数为________。(用NA表示阿伏加德罗常数的值)
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是______,其质量为_______ 克
②从A瓶中获得沉淀质量的操作是_____、称量。
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题。

⑴铜片上的现象是__________________________ ,电极反应为________________ ,_____________(填“锌片”或“铜片”)只起传导电子的作用。
⑵电子由_____________经导线流向_____________ ,_____________为负极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com