
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图所示。

(1)电源的正极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________、_________。
(3)电解结束后,阴极室溶液的pH与电解前相比将__________;(填“增大”、“减小”或“不变”),若两极共收集到气体8.96 L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
【答案】 A 2Cl--2e-===Cl2↑ CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl 不变 4.8
【解析】本题主要考查电解池原理。
(1)右边电极产生还原产物H2,所以电源的正极为A。
(2)阳极室中发生的反应依次为2Cl--2e-===Cl2↑ 、CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl。
(3)阴极反应:2H2O+2e-![]() H2↑+2OH-,同时H+从左到右通过质子交换膜,因此,电解结束后,阴极室溶液的pH与电解前相比不变。3H2~CO(NH2)2~N2+CO2,每除去60g尿素,同时生成5mol气体,若两极共收集到气体8.96 L即0.4mol(标准状况),则除去的尿素4.8g。
H2↑+2OH-,同时H+从左到右通过质子交换膜,因此,电解结束后,阴极室溶液的pH与电解前相比不变。3H2~CO(NH2)2~N2+CO2,每除去60g尿素,同时生成5mol气体,若两极共收集到气体8.96 L即0.4mol(标准状况),则除去的尿素4.8g。


科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______________________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 所用试剂 |
A | 提纯混有MgCl2杂质的AlCl3溶液 | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 |
B | 检验NH4Cl固体中的阳离子 | 试管、酒精灯 | NH4Cl固体、红色石蕊试纸、蒸馏水 |
C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
D | 测定FeSO4溶液的浓度 | 酸式滴定管、锥形瓶、 烧杯 | 0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子和分子是粒子存在的两种重要形式,一些粒子在人的生理活动中发挥着重要的作用。下列常见的粒子中,没有还原性的是( )
A.Cl-B.Na+C.N2D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
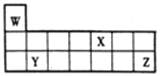
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强酸弱碱形成的盐溶液呈酸性,则你认为“84消毒液”的有效成分是( )
A. 氯化氢 B. 次氯酸钠 C. 高锰酸钾 D. 碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
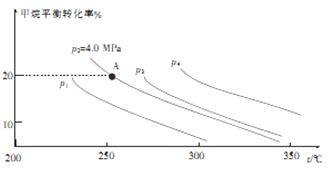
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
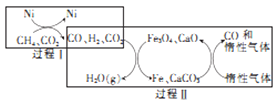
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
海藻![]() 海藻灰
海藻灰![]() 海藻灰悬浊液
海藻灰悬浊液![]()

(1)写出提取碘的过程中有关实验操作的名称:①______;③________。
(2)提取碘的过程中可供选择的有机溶剂是(____)
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是____________________________________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:①______,②________,③________,④________。

(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在________里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com