
已知:
Ⅴ由化合物Ⅲ合成:
请回答下列问题:
(1)化合物Ⅱ的分子式为???????????? ,Ⅲ的含氧官能团的名称为??????????? 。
(2)反应①~③中,属于加成反应的是??????? ____________。
(3)化合物II与足量的H2(Ni作催化剂)加成后再在酸性条件下水解,所得产物之一可以发生聚合反应,写出该聚合产物的结构简式为:______________________________。
(4)1 mol化合物Ⅱ与C9H8的混合物完全燃烧时消耗O2的量为__________mol。
(5)化合物II与NaOH溶液能很快完全反应,写出该反应方程式:?????????????????? 。
(6)化合物II也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质的结构简式为????????????????? 。
(7)写出满足下列条件的IV的同分异构体的结构简式???????????????????????????? 。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰
(1)C10H10O3(2分)?? 羰基和酯基(2分,各1分)
(2)③(2分)??
(3)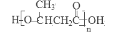 (2分)
(2分)
(4)11 (2分)
(5)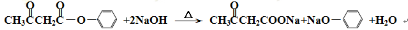
(2分,配平1分)
(6)CH3COCH3(2分)?
(7)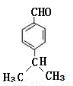 (3分)
(3分)
【解析】
试题分析:(1)由化合物Ⅱ的结构简式得出分子式为,Ⅲ的含氧官能团的名称为酯基和羰基,要注意流程中的羰基有点像醚键,所以不要认错。
(2)从所给的流程中看出反应①、②均有小分子生成,所以不是加成反应,而反应③中化合物IV中的羰基与NaHSO3发生加成反应,使得羰基被还原为了羟基。
(3)化合物II与足量的H2(Ni作催化剂)加成后,羰基被还原为-OH,再在酸性条件下水解,酯基变成了-COOH,所以可以发生聚合反应的产物是既含有-OH又含有-COOH的化合物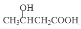 ,所以其发生聚合反应生成的聚合物分子式为
,所以其发生聚合反应生成的聚合物分子式为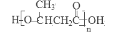 。
。
(4)1mol有机物CxHyOz的耗氧量满足x+y/4+z/2,所以根据化合物Ⅱ的分子式为C10H10O3与C9H8 可知1mol二者耗氧量都是11mol,所以无论它们如何混合可以看成全部是化合物Ⅱ,所以消耗的氧气为11mol。
(5)化合物是Ⅱ是酯类,所以在氢氧化钠溶液中发生水解反应,方程式为: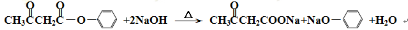
(6)反应②发生的是酯水解和脱羧基反应,所以化合物II发生水解和脱羧基反应后,产物为丙酮CH3COCH3 。
(7)IV的同分异构体能够发生银镜反应,说明含有醛基结构,由于只有2个取代基处于对位结构,所以要满足核磁共振氢谱吸收峰的结构简式为 。
。
考点:本题考查的是有机化合物的推断。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
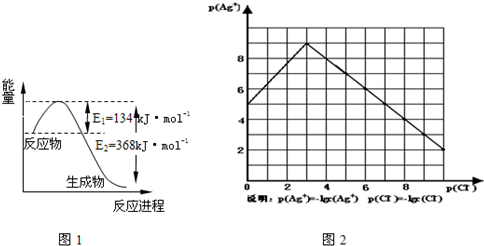
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
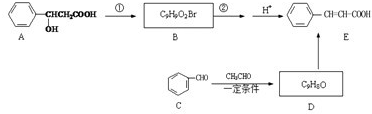
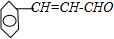
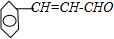
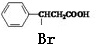 +NaOH
+NaOH| H2O |
| △ |
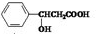 +NaBr
+NaBr +NaOH
+NaOH| H2O |
| △ |
 +NaBr
+NaBr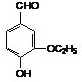 是有机物A的同分异构体,下列说法错误的是
是有机物A的同分异构体,下列说法错误的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com