
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量硫酸钠溶液,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)不变 | D. | 滴加少量CuSO4溶液,v(H2)减小 |
分析 Zn与硫酸反应中,氢离子浓度增大,反应速率加快,氢离子浓度减小,则反应速率减小,构成原电池可加快反应速率,以此来解答.
解答 解:A.加入NH4HSO4固体,电离出氢离子,氢离子浓度增大,v(H2)增大,故A错误;
B.加入Na2SO4固体溶液,体积增大,氢离子浓度减小,v(H2)减小,故B正确;
C.加入CH3COONa固体,反应生成醋酸,氢离子浓度减小,则v(H2)减小,故C错误;
D.滴加少量CuSO4溶液,构成原电池,v(H2)增大,故D错误;
故选:B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L CCl4 含有的分子数为0.1NA | |
| B. | 500mL lmol•L-1的K2SO4溶液中K+的物质的量为2mol | |
| C. | 25℃,101KPa 下,11.2L CO2中所含氧原子个数小于NA | |
| D. | 2.7gAl与足量稀盐酸反应,转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g/mol | B. | 108g/mol | C. | 55g/mol | D. | 96g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐被氧化过程中氮和碳的化合价均升高 | |
| C. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


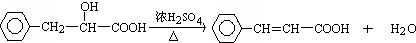 .
. .
. .
. 、
、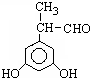 .
. (其中X、Y均部位H)
(其中X、Y均部位H)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com