
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)弱酸根离子水解程度越大,钠盐溶液的pH越大,则对应的酸的酸性越弱;
(2)根据易水解的盐促进水的电离,酸碱抑制水的电离,据此分析;
(3)次氯酸钠在溶液中水解,溶液显碱性;
(4)依据溶度积常数比较组成相同的难溶物溶解度;
(5)苯酚钠是能水解的盐,溶液显碱性,据此判断离子浓度的大小关系;
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN).
解答 解:(1)弱酸根离子水解程度越大,钠盐溶液的pH越大,则对应的酸的酸性越弱,pH:NaCN>NaClO,则酸性:HClO>HCN,故答案为:HClO>HCN;
(2)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8.8}}$=10-5.2mol/L
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5.2}}$=10-8.8mol/L;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;0.2mol/L的NaCN溶液,促进水的电离比0.1mol/L的NaCN溶液促进水的电离程度小点,0.1mol/L水电离的c(H+)=10-11.1mol/L,水电离的c(H+)=10-11.1mol/L,0.2mol/L的NaCN溶液中水电离的c(H+)<10-11.1mol/L,所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:B;
故答案为:B;
(3)次氯酸钠在溶液中水解,溶液显碱性,其水解离子方程为ClO-+H2O?HClO+OH-,故答案为:ClO-+H2O?HClO+OH-;
(4)如果将碳酸钠溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,已知Ksp(BaCO3)=5.1×10-9mol2•L-2,Ksp(ZnCO3)=1.4×10-11 mol2•L-2;
组成相同的难溶物,溶度积越小越难溶,在溶液中越易生成沉淀,所以先沉淀的是ZnCO3;
故答案为:ZnCO3;
(5)苯酚钠中弱酸阴离子能水解,溶液显碱性,则c(OH-)>c(H+),所以溶液中的离子浓度关系为:c(Na+)>>c(C6H5O?)>c(OH-)>c(H+),
故答案为:c(Na+)>c(C6H5O?)>c(OH-)>c(H+);
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN),已知100℃时纯水中c(H+)=10-6mol/L,则Kw=10-12,NaCN溶液溶液的pH=n,所以c(OH-)=$\frac{Kw}{c({H}^{+})}$=10n-12mol/L,所以c(H+)+c(HCN)=10n-12mol/L,
故答案为:10n-12.
点评 本题考查了盐类水解原理的应用、水解方程式、离子浓度大小比较、溶度积常数的应用、溶液中守恒关系的应用等,题目综合性较强,注重对基础知识的综合应用的考查,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+ )=c(NO3 - ) | |
| B. | 1.0 mol•L-1Na2CO3 溶液:c(OH-)=c(HCO3-)+c(H+) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素中,元素Z的非金属性最强 | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | Y、Z、W三种元素的原子半径大小顺序:r(Z)>r(W)>r(Y) | |
| D. | YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
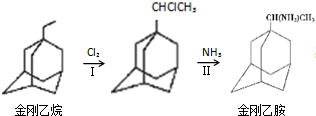
 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油主要成分都是碳氢化合物 | |
| B. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| C. | 天然气和沼气的主要成分是甲烷 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
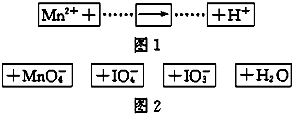
| A. | IO4作氧化剂 | |
| B. | 若有1molMn2+参加反应转移5mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 配平后Mn2+、H+的化学计量数分别为2、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com