
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0 B.△H2>0,△H4>0
C.△H1=△H2+△H3 D.△H3=△H4+△H5
【答案】C
【解析】
试题分析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g) △H2,③2CO(g)+O2(g)=2CO2(g) △H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s) △H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3=![]() ,D错误,答案选C.
,D错误,答案选C.


科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )
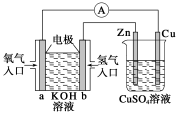
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用亚硝酸钠(NaNO2)作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备NaNO2并探究NO、NO2的某一化学性质(A中加热装置已略去)。

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
请回答下列问题:
(1)装置A三颈烧瓶中发生反应的化学方程式为__________________。
(2)用上图中的装置制备NaNO2,其连接顺序为:a→_____________→h(按气流方向,用小写字母表示),此时活塞K1、K2如何操作_______________________。
(3)E装置发生反应的离子方程式是________________________。
(4)通过查阅资料,NO2或NO可能与溶液中Fe2+发生反应。某同学选择上述装置并按A→C→E顺序连接,E中装入FeSO4溶液,进行如下实验探究。

步骤②操作的目的是__________________;步骤③C瓶中发生的化学方程式为________________;
通过实验可以得出:___________(填“NO2、NO中的一种或两种”)和溶液中Fe2+发生反应使溶液呈深棕色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)①的元素符号为______;②的元素符号为______;③的元素符号为______;④的元素符号为______;⑤的元素符号为______;⑥的元素符号为______;⑦的元素符号为______;⑧的元素符号为_______
(2)⑥的原子结构示意图为_________。
(3)⑧的气态氢化物为_____________(填化学式)。
(4)⑤对应的碱的化学式为__________;③的最高价含氧酸为___________。(填化学式)
(5)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )

A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L·min)
D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是
①加入AgNO3溶液;②加入NaOH溶液;③加热;④加入蒸馏水;⑤加入HNO3酸化
A.②③⑤① B.④③⑤① C.④①⑤ D.②③①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com