
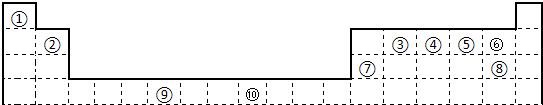
(10分)下表为长式周期表的一部分,其中的编号代表对应的元素。

⑴表中属于ds区的元素是 (填编号)。
⑵元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是 。
A.分子中含极性共价键
B.含有1个σ键和2个π键
C.属于非极性分子
D.该化合物分子中,②原子采用sp2杂化
⑶根据上述表格中的十种元素填空:
I、金属性最强的主族元素的电子排布式为_____________;
II、⑤、⑥、⑦的离子半径由小到大的顺序是___________ (填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是_____ _ (填化学式), *
⑷某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ___;该元素与元素①形成的分子X的空间构型为 。
(1) ⑩(1分)
⑵A B C (2分)
⑶I、1S22S22P63S23P64S2 (1分)II、Al3+< Cl-< S2- (2分)III、 HClO4 > H2SO4 (2分)
(4) 1(2分) 三角锥型 (1分)
【解析】
|
氢 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
碳 |
|
氧 |
|
|
|
|
镁 |
|
|
|
|
|
|
|
|
|
|
铝 |
|
|
硫 |
氯 |
|
|
|
钙 |
|
|
|
|
|
|
|
镍 |
铜 |
|
|
|
|
|
|
|
(1)IB、IIB元素属于ds区;
(2)干冰(固态二氧化碳)用于人工降雨:
二氧化碳属于极性键形成的非极性分子,故A、C正确;
有一个共价键“头碰头”形成σ键后,那两个共价键只能“肩并肩”形成两个π键,故C正确;
该化合物分子中,碳原子采用sp杂化,故D错误;
⑶I、金属性最强的主族元素是左下角的钙元素,其电子排布式为1S22S22P63S23P64S2;
II、Al3+(核外两层电子)< Cl-(核外三层电子)< S2-(核外三层电子)(具有相同核外电子排布的离子,原子序数越大,离子半径越小);
III、同周期,由左到右,最高价氧化物对应的水化物的酸性逐渐增强;
⑷从电子排布式(nsnnpn+1)可以看出:n=2,则电子排布式为2s22p3,该元素为氮元素,孤对电子数为2s2中的1对;NH3为三角锥型结构


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:阅读理解



| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
| ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com