

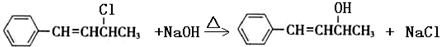 .
.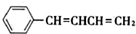 .
. 分析 (1)反应①中化合物I的结构简式为CH3COCH2COOCH2CH3,根据结构简式可得分子式,写出反应的方程式可得耗氧量;
(2)醇中羟甲基(-CH2OH或HOCH2-)在Cu催化下与过量O2反应生成能发生银镜反应的醛基(-CHO或OHC-),依题意可知A的碳链两端各有1个羟甲基(-CH2OH或HOCH2-),CH3COOCH2CH3的分子式为C4H8O2,减去2个C、6个H、2个O之后可得2个C、2个H,即A的碳链中间剩余基团为-CH=CH-,则A的结构简式为HOCH2CH=CHCH2OH,以此为突破口,可以推断B的结构简式为OHCCH=CHCHO;
(3)II的结构简式为C6H5CH=CHCHOHCH3,其分子式为C10H12O,C属于卤代烃,其分子式为C10H11Cl,C比II多1个Cl少1个OH,C与 NaOH水溶液共热生成II,说明C的结构简式为C6H5CH=CHCHClCH3,根据卤代烃的性质可书写并配平其水解反应的化学方程式;
(4)根据卤代烃与NaOH乙醇溶液共热发生消去反应的原理,C与NaOH乙醇溶液共热生成的有机产物可能是C6H5CH=C=CHCH3、C6H5CH=CHCH=CH2,前者的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为1:1:3,因此不符合题意,则化合物IV的结构简式为C6H5CH=CHCH=CH2.
解答 解:(1)反应①中化合物I的结构简式为CH3COCH2COOCH2CH3,其分子式为C6H10O3;根据烃的含氧衍生物燃烧通式可得:C6H10O3+7O2$\stackrel{点燃}{→}$6CO2+5H2O,其中氧气与I的物质的量之比等于系数之比,则1molI完全燃烧最少需要消耗7mol O2;
故答案为:C6H10O3; 7;
(2)醇中羟甲基(-CH2OH或HOCH2-)在Cu催化下与过量O2反应生成能发生银镜反应的醛基(-CHO或OHC-),依题意可知A的碳链两端各有1个羟甲基(-CH2OH或HOCH2-),CH3COOCH2CH3的分子式为C4H8O2,减去2个C、6个H、2个O之后可得2个C、2个H,即A的碳链中间剩余基团为-CH=CH-,则A的结构简式为HOCH2CH=CHCH2OH,以此为突破口,可以推断B的结构简式为OHCCH=CHCHO,
故答案为:HOCH2CH=CHCH2OH; OHCCH=CHCHO;
(3)C的结构简式为C6H5CH=CHCHClCH3,与NaOH在加热条件下发生水解反应,反应的方程式为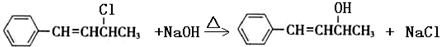 ,
,
故答案为: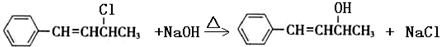 ;
;
(4 )C与NaOH乙醇溶液共热生成的有机产物可能是C6H5CH=C=CHCH3、C6H5CH=CHCH=CH2,前者的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为1:1:3,因此不符合题意,则化合物D的结构简式为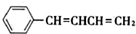 ,故答案为:
,故答案为: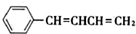 .
.
点评 本题考查考生对烯烃、炔烃、卤代烃、醇、醛、酯等常见有机物的结构和成键特征的了解;考查考生对以上有机物典型代表物的组成和性质以及它们相互联系的了解;考查考生对重要有机反应类型如取代反应、加成反应、消去反应和氧化反应的了解;考查考生对核磁共振氢谱峰组数和峰面积之比的了解;考查考生对有机化合物同分异构现象的了解;考查考生的分析能力、逻辑推理能力、综合应用信息以及信息迁移能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:实验题
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2 O | |
| C. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 纯碱溶液中通入二氧化碳:CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{60}×22.4$L | B. | $\frac{W}{100}×22.4$L | C. | $\frac{W-a}{40}×22.4$L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔、沸点 | |
| B. | 棉花、蚕丝的主要成分都是纤维素 | |
| C. | 常温常压下,0.1 mol D${\;}_{2}^{18}$O中含有的中子数、质子数、电子数均为NA | |
| D. | 乙烯和苯都能使溴水中的水层褪色,褪色的原因相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com