
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:


下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度,40 min时升高温度
D. 30 min时减小压强,40 min时升高温度
【答案】D
【解析】
由图象可以知道,30 min~40 min之间,反应速率降低了,平衡不移动,反应物与生成物的浓度瞬时降低,催化剂不能改变浓度,故不能是温度变化,而是降低了压强;
由开始到达到平衡,A、B的浓度减少的量相同,由此可以知道x=1。则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,以此解答该题。
详解:A. 由图象可以知道,30 min~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可以知道x=1,反应前后气体体积不变,则增大压强平衡不移动,40 min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;
C.降低温度,平衡发生移动,则正逆反应速率不相等,故C错误;
D.由图象可以知道,30 min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40 min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,所以D选项是正确的。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____mol/L。
若加入少量NaOH固体,则溶液中![]() _____(填"增大”、“减小”或“不变”)。
_____(填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32- ____(填“能”或“不能”)大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______。当pH=7时,溶液中含碳元素的微粒主要为_________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=_____。
HCO3-+OH-的平衡常数Kh=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,以H2SO4溶液为电解质溶液的这种电池的原理图如下图所示,回答下列问题:

(1)电极b为电池__________极,其电极反应式为___________ ,反应类型为________
(2) 当电路中转移3mol电子时,a极有________L氢气(标准状况)参与反应。
(3)氢氧燃料电池的优点____________(任写两点)。
(4)除了燃料电池外,我们生活中经常用到充电电池,下列关于充电电池的叙述,不正确的是(______)
A、充电电池的化学反应原理是氧化还原反应
B、充电是使放电时的氧化还原反应逆向进行
C、充电电池可以无限制地反复充电、放电
D、较长时间不使用电器时,最好从电器中取出电池,并妥善存放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。 下列有关化学图像表现的内容正确的是
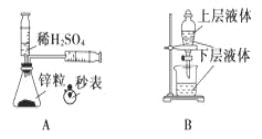
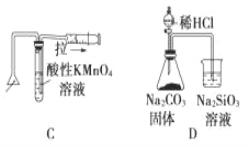
A. 测定一定时间内生成 H2 的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的 SO2 D. 证明非金属性:Cl>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
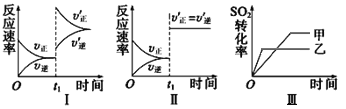
A.图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响
B.图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
C.图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入400 mL 0.01 mol·L-1的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
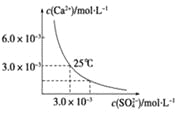
A. 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B. 溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C. 溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO 42-)都变小
D. 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为 101℃,易溶于水,受热易脱水、升华,170℃以上分解。 常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体 175℃分解成 CO2、CO、H2O,请写出草酸晶体分解的化学反应方程 式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量 CO 气体,最佳的连接顺序 为:_____。(填字母序号)
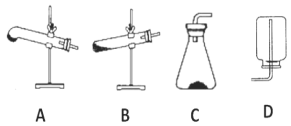
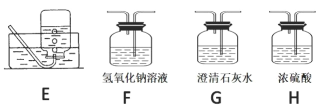
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____(填序号)。
A.室温下,测 0.1mol/L 的 H2C2O4 溶液与 H2SO4 溶液的 pH,硫酸溶液的 pH 比草酸的小;
B.室温下,取 pH=3 的 H2C2O4 溶液稀释 100 倍后,测其 pH<5;
C.标况下,取 0.10mol/L 的 H2C2O4 溶液 100mL 与足量锌粉反应,收集到 H2 体积为 224mL。
(4)现需要配制 900mL1mol/L 的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、________ 、_________ (填仪 器名称)。
②下列操作会使所配溶液浓度偏低的是_____。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O 晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定 KMnO4 溶液的方法可测定 KMnO4 粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____。
②量取 KMnO4 样品溶液应选用_________ (填“酸式”或“碱式”)滴定管;若量取 KMnO4 样品溶液的 滴定管用蒸馏水洗净后未润洗,则最终的测定结果将_______(填“偏大”、“偏小”或“不变”)。
③现取 KMnO4 粗品 10g,配成 100mL 溶液,取 25.0 mL 用(4)中配制的草酸溶液滴定,并进行 3 次 平行实验,所用的草酸溶液的体积分别为 23.00 mL、20.02 mL、19.98 mL,请问 KMnO4 粗品的质量分数 为_____________。(已知:KMnO4 的摩尔质量为 158g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.工业用焦炭在高温下还原二氧化硅制得高纯硅
B.SiO2可用于制造光导纤维
C.钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来
D.氧化镁熔点高达250℃,是优质的耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
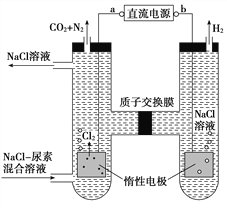
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com