
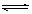 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。| A.2Q2<Ql<Q | B.2Q2=Q1<Q | C.2Q2=Q1=Q | D.Ql<Q2<Q |
科目:高中化学 来源:不详 题型:单选题
| A.向反应体系中加入催化剂以加快化学反应速率 |
| B.温度越高,化学反应速率越快 |
| C.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 |
| D.温度越高, 工业合成氨的产率越低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
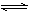 NH3·H2O
NH3·H2O 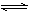 NH
NH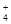 +OH-
+OH- 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
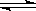 CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。| 改变条件 | 电离平衡移动方向 | c(H+) | c(CH3COO-) |
| 加水稀释 | | | |
| 加少量冰醋酸 | | | |
| 加入少量CH3COONa固体 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.80.0% | B.20.0% | C.16.7% | D.83.3% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c 2 | c 3 | c 3 |
| 4 | c 1 | c 2 | c 3 | c 3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol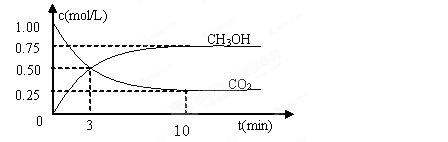
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 H2 |
 同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)
同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com