
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A.反应能否发生与反应物与生成物的总能量大小无关;
B.中和热是强酸强碱稀溶液中和生成1mol水放出的热量;
C.物质的总能量与稳定性关系是能量越高越活泼;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量.
解答 解:A.反应物的总能量低于生成物的总能量时,说明反应吸热,反应能否发生与与反应物与生成物的总能量大小无关,例如氢氧化钡与硫酸铵结晶水合物的反应属于吸热反应,但在常温下就能进行,而铝热反应属于放热反应,需在高温下才能进行,故A错误;
B.强酸跟强碱反应放出的热量不一定是中和热,如1molH2SO4和2molNaOH反应放出的热量不是中和热,故B错误;
C.由反应C(金刚石,s)═C(石墨,s)△H<0,反应放热说明石墨的总能量小于金刚石的总能量,可知石墨比金刚石稳定,故C正确;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故D错误.
故选C.
点评 本题考查化学反应能量,题目难度中等,注意理解反应热与能量的关系,能量与稳定性的关系,以及正确理解燃烧热的概念.


科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |
 ,用电子式表示形成化合物丁的过程
,用电子式表示形成化合物丁的过程
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
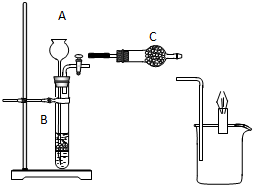 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与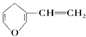 互为同分异构体的芳香族化合物有5种 互为同分异构体的芳香族化合物有5种 | |
| C. | 含有5个碳原子的饱和链烃,其一氯取代物有3种 | |
| D. | 菲的结构简式为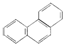 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥⑨⑩ | B. | ①③④⑦⑧⑨⑩ | C. | ①②③④⑦⑧⑨ | D. | ①②④⑤⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com