
(1)锂在空气中燃烧,除生成__________外,也生成微量的__________。
(2)铍的最高价氧化物对应的水化物的化学式是__________,属两性化合物,证明这一结论的有关离子方程式为____________________、____________________。
(3)若已知反应Be2C+4H2O====2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为________________________________________。
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是__________。用电子式表示BeCl2的形成过程:________________________________________。
解析:(1)根据对角线规则,锂与镁的化学性质相似,在空气中除与O2作用生成Li2O外,还可与N2作用生成Li3N。(2)铍为第2周期第ⅡA族元素,与Al处于对角线位置,对照Al(OH)3的两性反应有:Be(OH)2+2H+====Be2++2H2O,Be(OH)2+2OH-====![]() +2H2O (3)由于Be、Al元素性质相似,依据所给信息有:Al4C3+12H2O====4Al(OH)3+3CH4↑,当强碱过量时有Al(OH)3+OH-====
+2H2O (3)由于Be、Al元素性质相似,依据所给信息有:Al4C3+12H2O====4Al(OH)3+3CH4↑,当强碱过量时有Al(OH)3+OH-====![]() +2H2O,合并为:Al4C3+4OH-+4H2O====
+2H2O,合并为:Al4C3+4OH-+4H2O====![]() +3CH4↑。(4)根据共价化合物与离子化合物的结构特点可知离子化合物在溶于水或熔化时导电,而共价化合物熔化时不导电,因此可将BeCl2加热至熔融状态,若不导电则可证明之。
+3CH4↑。(4)根据共价化合物与离子化合物的结构特点可知离子化合物在溶于水或熔化时导电,而共价化合物熔化时不导电,因此可将BeCl2加热至熔融状态,若不导电则可证明之。
答案:(1)Li2O Li3N
(2)Be(OH)2 Be(OH)2+2 H+====Be2++2H2O Be(OH)2+2 OH-====Be![]() +2H2O
+2H2O
(3)Al4C3+4 OH-+4H2O====![]() +3CH4↑
+3CH4↑
(4)将BeCl2加热至熔融状态,不能导电
![]()


科目:高中化学 来源: 题型:
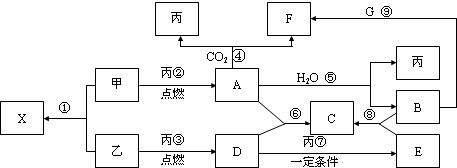


查看答案和解析>>
科目:高中化学 来源: 题型:
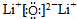
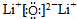


查看答案和解析>>
科目:高中化学 来源: 题型:
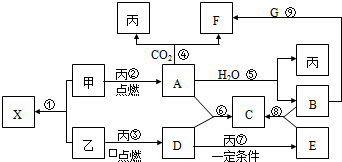


查看答案和解析>>
科目:高中化学 来源: 题型:
| 过量浓硫酸 |
| 一定量NaOH溶液 |
| D的溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com