
| A. | ①② | B. | ② | C. | ①③ | D. | ②④ |
分析 ①A为纯固体,改变量,对平衡移动无影响;
②该反应为放热反应,升高温度,反应速率增大,向吸热方向移动;
③该反应为气体体积不变的反应,增大压强,正逆反应速率同等程度增大;
④增大反应物的浓度,平衡正向移动;
⑤催化剂对平衡移动无影响.
解答 解:①A为纯固体,增加A的量,平衡不移动,故错误;
②该反应为放热反应,升高温度,反应速率增大,向吸热方向移动,则平衡向逆反应方向移动,故正确;
③该反应为气体体积不变的反应,增大压强,正逆反应速率同等程度增大,平衡不移动,故错误;
④增大反应物的浓度,平衡正向移动,则v(正)>v(逆),故正确;
⑤催化剂对平衡移动无影响,则加入催化剂,B的转化率不变,故错误;
故选D.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意A为固体及反应的特点,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 | |
| C. | “出汗”→变成白色固体(粉末)过程中只发生物理变化 | |
| D. | 最后变成碳酸钠粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何一个水分子,其本身都是固体 | |
| B. | 逐渐加热升温,碳酸氢铵也可体现出三态变化 | |
| C. | 面包是固体,但在受压时体积缩小,故可以说固体易被压缩 | |
| D. | 在水蒸气、液态水和冰中,水分子都在不停地运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
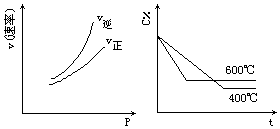 都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )
都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )| A. | N2O3(g)?NO2(g)+NO(g)-Q | B. | 3NO2(g)+H2O(l)?2HNO3 (aq)+NO(g)+Q | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+Q | D. | CO2(g)+C(s)?2CO(g)-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
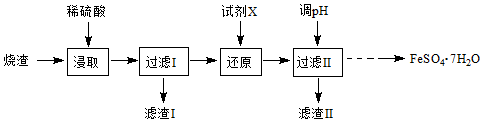
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com