
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | “血液透析”利用了胶体的性质 |
分析 A、石油是混合物,汽油也是混合物;
B、油脂不属于高分子化合物;
C、金属氧化物不一定都是碱性氧化物,可以是两性氧化物或酸性氧化物;
D、血液是胶体,不能通过半透膜.
解答 解:A、石油是混合物,其分馏产品汽油是一定温度范围内的馏分,属于多种烃的混合物,故A错误;
B、淀粉、纤维素都属于天然高分子化合物,油脂不属于高分子化合物,故B错误;
C、金属氧化物不一定是碱性氧化物,如:Mn2O7是酸性氧化物,Al2O3是两性氧化物,故C错误;
D、血液是胶体,胶粒不能透过半透膜,故D正确;
故选D.
点评 本题考查化学基本概念,易错选项是C,注意金属氧化物不一定是碱性氧化物,为易错点,题目较简单.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.
 .
. +HBr+CH3Br.
+HBr+CH3Br. 等.
等. 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
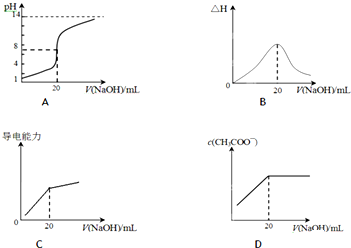 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
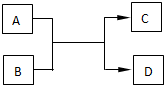 学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.
学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系.已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;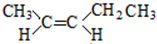 、
、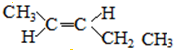 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
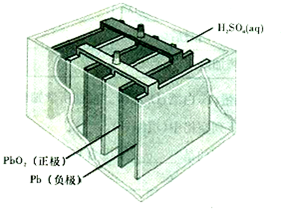
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
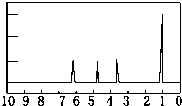 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
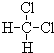 和
和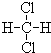 ;
;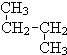 和
和 ⑦CH3 (CH2) 3CH3和
⑦CH3 (CH2) 3CH3和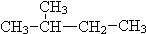
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com