Ⅰ以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工业.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H
2O(g)

CO(g)+H
2(g)△H=+131.3kJ?mol
-1,
该反应在常温下
自发进行(填“能”与“不能”);在一体积为2L的密闭容器中,加入1molC和2mol H
2O(g),达平衡时H
2O的转化率为20%,请计算此时的平衡常数
(2)目前工业上有一种方法是用CO与H
2反应来生产甲醇.
| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
已知生成气态甲醇,CO里面含C≡O.请写出该反应的热化学方程式为
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N
2(g)+3H
2(g)

2NH
3(g)△H=-92.4kJ/mol
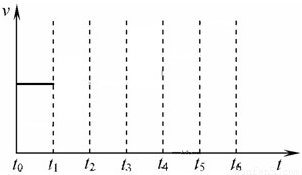
在一体积不变的容器中,当合成氨反应达到平衡后,在t
1时升高温度,t
2重新达到平衡,t
3时充入氮气,t
4时重新达到平衡,t
5时移去一部分产物,t
6时又达到平衡,请在下面的反应速率与时间关系图中画出t
1到t
5逆反应速率、t
5到t
6正反应速率的变化情况.
(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O
2-.则通丙烷的电极发生的电极反应为
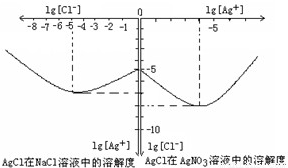
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl
-=[AgCl
2]
-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
.

 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1, 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol

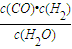 ,结合水的转化率求出参加反应的水的物质的量,根据三段式用求出出各组分的物质的量变化量、平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数计算;
,结合水的转化率求出参加反应的水的物质的量,根据三段式用求出出各组分的物质的量变化量、平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数计算; CO(g)+H2(g),
CO(g)+H2(g),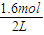 =0.8mol/L,CO和H2的浓度为
=0.8mol/L,CO和H2的浓度为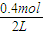 =0.2mol/L,
=0.2mol/L,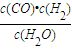 =
=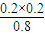 =0.05,
=0.05,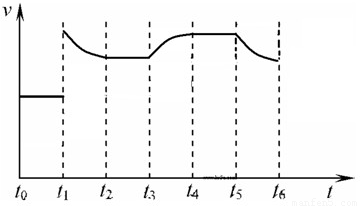 ,故答案为:
,故答案为: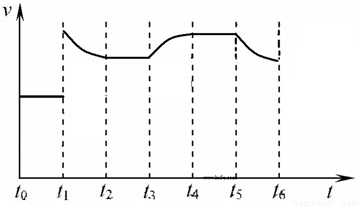 ;
;

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 2CH3CHO+2H2O
2CH3CHO+2H2O 2CH3CHO+2H2O
2CH3CHO+2H2O +HO-NO2
+HO-NO2 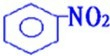 +H2O
+H2O +HO-NO2
+HO-NO2  +H2O
+H2O
