
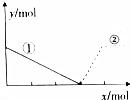
 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )| A. | ①Al3+ ②Al(OH)3 | B. | ①Al3+ ②AlO2- | ||
| C. | ①Al(OH)3 ②Al3+ | D. | ①AlO2- ②Al3+ |
分析 假定向含有AlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,据此结合曲线①、②变化分析.
解答 解:向AlCl3溶液中逐滴加入NaOH溶液,发生反应Al3++3OH-=Al(OH)3↓,物质的量减小的为Al3+,则曲线①表示的是Al3+;
当Al3+完全转化成氢氧化铝沉淀后,再加入NaOH溶液,发生反应Al(OH)3+OH-=AlO2-+2H2O,则AlO2-逐渐增加,之至的AlO2-物质的量达到最大,则曲线②表示的是AlO2-,
故选B.
点评 本题考查了铝的化合物性质,题目难度不大,明确发生反应实质为解答关键,注意掌握铝离子与氢氧根离子的反应特点,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释溶液,[OH-]减小 | |
| B. | 加入NaOH固体,$\frac{[S{O}_{3}^{2-}]}{[{H}_{2}S{O}_{3}]}$增大 | |
| C. | 升高温度,②的平衡常数K增大 | |
| D. | 加入硝酸,[H2SO3]减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 纯碱溶液中滴加少量盐酸:CO32-+H+=HCO3- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H=Fe2++H2S↑ | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-=CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com