
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
【答案】A
【解析】A、反应CH4+2O2![]() CO2+2H2O中,氧元素化合价由0价降为-2价,O2是氧化剂,碳元素化合价由-4价升高为+4价,CH4是还原剂,故A正确;B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,氯元素化合价由0价降为-1价,Cl2是氧化剂,部分氯元素化合价由0价升高为+1价,Cl2是还原剂,故B错误;C. 反应MnO2+4HCl(浓)
CO2+2H2O中,氧元素化合价由0价降为-2价,O2是氧化剂,碳元素化合价由-4价升高为+4价,CH4是还原剂,故A正确;B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,氯元素化合价由0价降为-1价,Cl2是氧化剂,部分氯元素化合价由0价升高为+1价,Cl2是还原剂,故B错误;C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,锰元素化合价由+4价降为+2价,MnO2是氧化剂,部分氯元素化合价由-1价升高为0价,HCl是还原剂,故C正确;D. 反应2Na+2H2O===2NaOH+H2↑中,H2O中氢元素化合价由+1价降为0价,是氧化剂,钠元素化合价由0价升高为+1价,钠是还原剂,故D错误;故选A。
MnCl2+Cl2↑+2H2O中,锰元素化合价由+4价降为+2价,MnO2是氧化剂,部分氯元素化合价由-1价升高为0价,HCl是还原剂,故C正确;D. 反应2Na+2H2O===2NaOH+H2↑中,H2O中氢元素化合价由+1价降为0价,是氧化剂,钠元素化合价由0价升高为+1价,钠是还原剂,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】已知在一定条件可发生如下两个化学反应:①Fe+H2SO4(稀)=FeSO4+H2↑,②2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,试回答下列问题:
Fe2(SO4)3+3SO2↑+6H2O,试回答下列问题:
(1)反应①中__元素(填元素名称)被还原,氧化产物为____;
(2)反应②中还原产物为__;该反应中,氧化剂与还原剂之比为___;
(3)标况下,当反应②中生成33.6LSO2气体时,被氧化的Fe有___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。
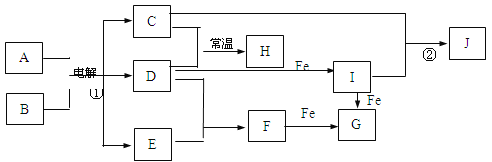
(1)H的化学式为____________。
(2)写出I与Fe反应生成G的离子方程式为_____________________________。
(3)反应①的化学方程式为____________________________________________。
(4)反应②的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____X=___
(2)A在5min末的浓度是___
(3)此时容器内的压强与开始时之比为:____。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。写出它的电子式______;
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___。Se2Cl2常用作分析试剂,其结构式为___。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④该反应中CuO作为氧化剂参与反应
(3) 配平反应:____H2S+___SO2=____S+____H2O。
其中,氧化产物为________,还原剂为________,氧化剂为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。
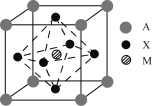
(1)吸光材料的化学式为___(用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____。
(3)溴原子基态核外价电子排布式为___。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___。
(5)CH3NH2中N原子的轨道杂化类型为__;1mol CH3NH3+中含σ键的数目为____。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____。
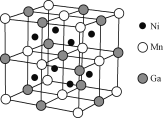
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___。每个Mn周围最近且等距离的Mn数目为___,每个Ga周围最近且等距离的Mn数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com