

| t1-t2 | t2-t3 | t3-t4 | t5-t6 |
| K1 | K2 | K3 | K4 |
| (0.6-0.3)mol/L |
| 15min |
| 1 |
| 2 |
| 1 |
| 2 |
| 2mol |
| 1mol/L |
| c3(C) |
| c2(A)c(B) |
| 0.6×0.6×0.6 |
| 0.8×0.8×0.4 |


科目:高中化学 来源: 题型:
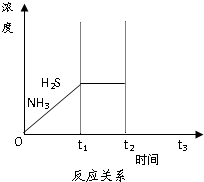 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题:
如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 需除杂的物质 | 所加试剂 | 主要操作 |
| A | CO2(SO2) | Na2CO3溶液 | 洗气 |
| B | Al2O3(SiO2) | NaOH溶液 | 过滤 |
| C | NO(NO2) | NaOH溶液 | 洗气 |
| D | Na2CO3(NaHCO3) | 不加任何试剂 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸氢钠与硝酸反应:HSO3-+H+═SO2↑+H2O |
| B、向氯化银悬浊液中加入浓碘化钠溶液:AgCl+I-═AgI+Cl- |
| C、碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═NH3↑+H2O |
| D、向氯化铝溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盛有少量浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片,可以证明浓硝酸氧化性强于稀硝酸 |
| B、用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,说明已达滴定终点 |
| C、实验室配制480mL 0.1mol/L NaOH溶液,需要准确称量NaOH 1.920g |
| D、铝箔在酒精灯火焰上加热时熔化但不滴落,是因为铝箔对熔化的铝有吸附作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com