
设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下4.4g乙醛所含σ键数目为0.7NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届河北省高三上学期二调化学试卷(解析版) 题型:推断题
(10分)某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
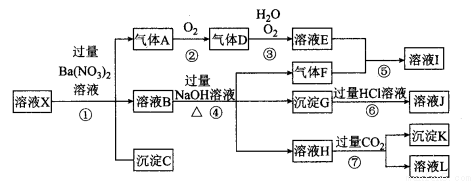
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于N03-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H20、02三种物质恰好发生化合反应生成E,则反应中D与02的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,
⑤KMn04溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三9月月考化学试卷(解析版) 题型:填空题
(10分)常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba 2+、Fe3+,已知:
2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶 液中生成沉淀,继续加氨水,Z中沉淀消失。
液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)___________ __________
(3)X和Z的溶液反应的离子方程式是____________________
(4)N和氨水反应的离子方程式是__________________
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________
查看答案和解析>>
科目:高中化学 来源:2016届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是____。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式____ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式____。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____ mol/L。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期开学考试化学试卷(解析版) 题型:填空题
(12分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
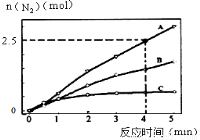
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
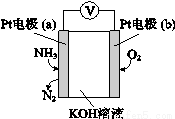
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省珠海市高三9月摸底考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述正确的是
A.25℃时,l L pH=13的 Ba(OH)2 溶液中含有的OH-数为0.2 NA
B.18g D2O中含有的质子数为9NA
C.Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为NA
D.标准状况下,11.2LCCl4含有的分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源:2016届广东省粤西“四校”高三上学期第一次联考化学试卷(解析版) 题型:选择题
化学无处不在,下列与化学有关的说法正确的是
A.Si有良好的半导体性能,可直接用于制备光导纤维
B.淀粉、纤维素、蛋白质、油脂都是天然高分子化合物
C.用食醋可除去热水壶内壁的水垢
D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
对于相同质量的CO和CO2,下列关系正确的是
A.所含氧原子的个数之比为1:2
B.所含碳元素的质量之比为7:11
C.所含氧元素的质量之比为11:14
D.所含碳原子的个数之比为1:1
查看答案和解析>>
科目:高中化学 来源:2016届江苏省宿迁市三校高三9月学情调研化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.苯甲醛: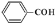 B.Mg2+的结构示意图:
B.Mg2+的结构示意图:
C.CO2的电子式: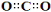 D.核内有8个中子的碳原子:
D.核内有8个中子的碳原子: C
C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com