
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: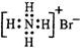 | D. | S2-离子结构示意图: |
分析 A.Cl原子半径大于C原子;
B.二氧化硅属于原子晶体;
C.溴化铵的电子式中,溴离子为阴离子,需要标出其最外层电子;
D.硫离子的核电荷数为16,核外电子总数为18,最外层含有8个电子.
解答 解:A.四氯化碳中氯原子的原子半径大于碳原子,四氯化碳的比例模型为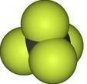 ,故A错误;
,故A错误;
B.二氧化硅属于原子晶体,二氧化硅是由硅原子和氧原子以1:2构成的,所以二氧化硅中不存在分子式,其化学式为SiO2,故B错误;
C.溴化铵为离子化合物,铵根离子和溴离子都需要标出所带电荷及原子的最外层电子,溴化铵正确的电子式为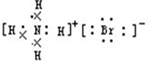 ,故C错误;
,故C错误;
D.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构,其离子结构示意图为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及比例模型、电子式的书写、原子结构示意图等,明确常见化学用语的书写原则为解答关键,易错点是原子晶体、离子晶体中不含分子,所以它们没有分子式,为化学式.


科目:高中化学 来源: 题型:解答题

 ;⑧的原子结构示意图为
;⑧的原子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,若电路中通过NA个电子,则阴极一定产生11.2LCl2 (标况) | |
| B. | lmolCH3COOC2H5在稀硫酸溶液中受热水解可得到乙醇分子数为NA | |
| C. | 含NA个Na+的Na2O2溶解于水配成2L溶液,所得溶液中Na+的物质的量浓度为0.5mol/L | |
| D. | 足量的MnO2固体与1L12mol/L的浓盐酸加热时反应,生成Cl2的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 能发生银镜发应 | |
| B. | 分子式为C10H10NO2 | |
| C. | 1mol 该物质最多可与5mol H2反应 | |
| D. | 吲哚-3-乙酸可发生加成反应和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2molH2O和D2O形成的混合物中,含有中子的数目为2NA | |
| B. | 含有0.1molNH4+的氨水中,含有OH-的数目为0.1NA | |
| C. | 400mL1mol•L-1稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA | |
| D. | 30g乙酸和乙酸乙酯的混合物完全燃烧,消耗O2的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═Mg CO3↓+CO32-+2H2O | |
| C. | Na2O2固体投入H218O中:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | 苯酚钠溶液跟AlCl3溶液反应:3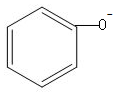 +Al3++3H2O→ +Al3++3H2O→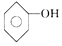 +Al(OH)3↓ +Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| B. | 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com