
 (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.分析 (1)酸碱中和反应和活泼金属与酸的反应都是放热反应;要构成原电池必须能自发的氧化还原反应;
(2)①原电池中电子从活泼的负极沿导线流向正极;阳离子向正极移动;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,以此分析解答.
解答 解:(1)酸碱中和反应和活泼金属与酸的反应都是放热反应,所以①②都是放热反应;要构成原电池必须能自发的氧化还原反应,NaOH+HCl=NaCl+H2O是非氧化还原反应,而Fe+H2SO4=FeSO4+H2↑是氧化还原反应,故答案为:①②;②;
(2)由图锌是负极,负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,
①电子从锌Zn片流出,溶液中H+向铜,故答案为:Zn;Cu;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,所以现象有气泡产生,故答案为:有气泡产生;还原;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,所以有0.01mol电子发生转移,生成标况的体积为0.112L,故答案为:0.112.
点评 本题考查原电池原理,侧重考查电极反应式书写、电子流向及阴阳离子移动方向等知识点,电解质溶液中阴阳离子移动方向是学习难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | FeSO4 | CuSO4 | 加入过量铁粉,过滤 |
| B. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
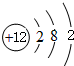 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com