
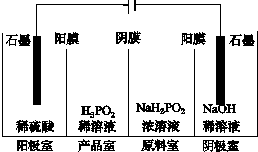
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:分析 (1)根据H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;
(2)根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐,强碱弱酸盐溶液水解呈碱性;
(3)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因;
③根据H3PO2及NaH2PO2均容易被氧化分析该装置缺点.
解答 解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2?H2PO2-+H+,故答案为:H3PO2?H2PO2-+H+;
(2)根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐,强碱弱酸盐溶液水解呈碱性,故答案为:正盐;弱碱性;
(3)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,
故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,
故答案为:PO43-;H2PO2-或H3PO2被氧化.
点评 本题考查了盐的水解原理、电解原理、弱电解质的电离、氧化还原反应等知识,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.


科目:高中化学 来源: 题型:选择题
| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于M的能量 | |
| B. | 因为该反应为放热反应,故不需要加热就能进行 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、D、T属于同一种核素 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式为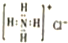 | |
| D. | S2-的结构示意图为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com