
| A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| B.用氨水吸收少量的SO2: NH3·H2O +SO2=NH4++HSO3- |
| C.用小苏打治疗胃酸过多:HCO3-+H+ = CO2↑+H2O |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+ |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:不详 题型:单选题
| A.往FeI2溶液中通入过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B.将明矾溶于水中生成胶体:Al3++3H2O??Al(OH)3(胶体)+3H+ |
| C.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、CO32- | B.Na+、HCO3- |
| C.HCO3-、CO32- | D.Na+、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na2CO3溶液与NaHSO4溶液反应: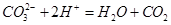 ↑ ↑ |
B.向硫酸铵溶液中加入氢氧化钡溶液: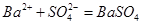 ↓ ↓ |
| C.Fe3O4与稀硝酸反应:Fe3O4 +8H+= 2Fe3++ Fe2+ +4H2O |
| D.少量金属钠加到冷水中:Na +2H2O=Na+ +OH- +H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在含Ag+、Cu2+的溶液中加入Zn:Ag+、Cu2+ |
| B.在含Fe3+、Br2的水溶液中滴加KI溶液:Fe3+、Br2 |
| C.在含NH4+、HCO3-的溶液中逐滴加入氢氧化钠溶液:NH4+、HCO3- |
| D.在含[Al(OH)4]-、OH-的溶液中逐滴加入盐酸:[Al(OH)4]-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水吸收过量的SO2:OH-+SO2=HSO3- |
| B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C.NaAlO2溶液中加入过量稀硫酸:AlO2-+H++H2O=Al(OH)3↓ |
| D.Cl2与稀NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+ H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe2++SO42—
Fe2++SO42— Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com