
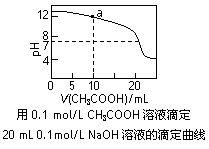
| A.若将四种溶液稀释100倍,溶液pH的大小顺序:③>④>①>② |
| B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④ |
| C.①与②混合,所得混合溶液的pH=3 |
| D.②和③混合后,溶液呈碱性 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L的盐酸溶液中由水电离的c(H+)=10—13mo1?L—l |
| B.Na2CO3溶液中加入少量Ca(OH)2固体,CO32—水解程度减小,溶液的pH减小 |
| C.CuSO4溶液蒸干得到Cu(OH)2固体 |
| D.等体积pH=3的醋酸溶液和pH=11的NaOH溶液相混合pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
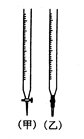
| A.V甲>V乙=V丙 | B.V甲>V丙>V乙 |
| C.V甲=V乙>V丙 | D.V甲=V乙=V丙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y3+、W- | B.Z2-、X+ | C.X+、Y3+ | D.X+、Z2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.滴定时,可用酚酞作指示剂 |
| B.a点表示反应终点 |
| C.在b点时:c(Na+)>c(A—)>c(OH—)>c(H+) |
| D.在d点时:c(A—)= c(Na+)>c(OH—)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com