
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
分析 电解时,电解池的阴极连接电源的负极,发生还原反应,电解池的阳极连接电源的正极,发生氧化反应,以此解答该题.
解答 解:A.电解池的阴极连接电源的负极,故A错误;
B.与直流电源正极相连的是电解池的阳极,故B错误;
C.与直流电源负极相连的电极为阴极,发生还原反应,故C正确;
D.阳极发生氧化反应,故D错误.
故选C.
点评 本题考查电解池知识,为高频考点,侧重于学生的双基的考查,解答本题需了解电解池阴、阳极的判断及电解的特点,电解池的阴、阳极是根据直流电源的正、负极确定的.与电源负极相连的电极为电解池的阴极,该电极上发生还原反应;与电源正极相连的电极为电解池的阳极,该电极上发生氧化反应.


科目:高中化学 来源: 题型:选择题
| A. | 在NaAlO2溶液中通入过量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
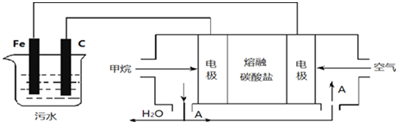
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
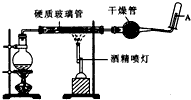 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com