
已知Fe3O4 可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ +2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O 下列说法不正确的是( )
A.O2是氧化剂,S2O32-、Fe2+ 是还原剂
B.当有1 mol Fe3O4 生成时共转移的电子为4mol
C.若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol
D.若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
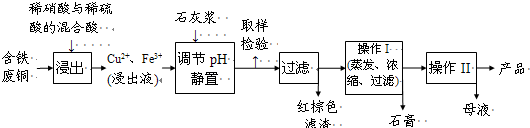
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 气体 | SO2 | N2 | O2 |
| 物质的量 | 10 | 58 | 6 |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
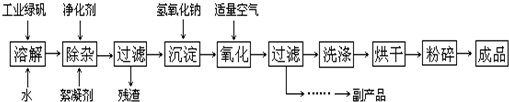
科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
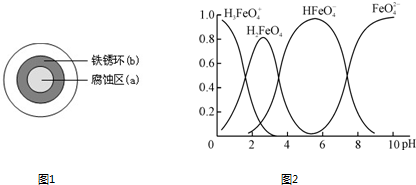
| FeO | 2- 4 |
| O | - 4 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市杨浦区高三上学期期中考试化学试卷(解析版) 题型:计算题
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
①产生的氢气的体积为_________mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量 mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________。T的化学式为____________。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
|
18K金成分 |
Au |
Ag |
Cu |
|
含量(质量分数) |
75.00% |
_________ |
_________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com